Самоорганизация полимеров
Как известно, спиральную конформацию имеют также важнейшие биологические молекулы - молекулы ДНК. Более того, спиральные конформации этих макромолекул фиксируются уже на молекулярном уровне; две молекулы, как правило, образуют совместную двойную спираль.
Остов молекул ДНК состоит из сахаро-фосфатных цепочек, а к каждому сахару присоединены плоские пуриновые или пиримидиновые основания, причем двухспиральные молекулы ДНК - сополимеры, содержащие четыре типа природных оснований: аденин (A), тимин (T), гуанин (Г) и цитозин (Ц). В двойной спирали основания, принадлежащие соседним цепям, соединены водородными связями (А-Т и Г-Ц). Для таких плоских пар их контакты друг с другом при укладке в стопку (стэкинг) оказываются энергетически более выгодными, чем их контакты с растворителем - водой, между лежащими друг над другом основаниями возникает так называемое (стэкинг) взаимодействие. Поэтому две взаимно комплементарные молекулы ДНК (у которых основанию А в одной цепи соответствует Т в другой, а основанию Г соответствует Ц) образуют регулярную двойную спираль, в которой основания связаны водородными связями в пары, пары уложены в стопку, а сахаро-фосфатные остовы двумя винтовыми линиями обвивают стопку. Наиболее плотная укладка оснований и соответственно наибольшие стэкинг-взаимодействия наблюдаются, когда плоскости оснований перпендикулярны оси двойной спирали (В-форма ДНК).
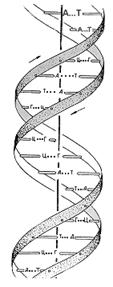

Как уже отмечалось для плоских пар оснований в ДНК, их контакты друг с другом оказываются энергетически более выгодными, чем контакты с водным растворителем, и они объединяются друг с другом, уменьшая число контактов с водой. Напротив, ионизованные фосфатные группы полностью погружены в водный растворитель [4]. Аналогичный принцип определяет и конформации другого класса биологических макромолекул -глобулярных белков. Основа белка -полипептидная цепь, образованная линейной последовательностью аминокислотных остатков (-NH-CHR-CO-), связанных друг с другом пептидной связью -CO-NH-. Радикал -R различен в разных аминокислотах (и аминокислотных остатках). Как известно, полипептидные цепи белков являются сополимерами 20 природных аминокислот, содержащих как неполярные, так и полярные радикалы R. Неполярные радикалы гидрофобны, они стремятся избежать контактов с водой и объединяются друг с другом, образуя ядро плотной глобулы. Полярные гидрофильные радикалы располагаются на поверхности глобулы, контактируя с водой (полярным растворителем). Отдельные короткие участки цепей могут быть уложены в регулярную спираль или складчатую структуру, эти так называемые вторичные структуры стабилизированы внутримолекулярными водородными связями. Общий ход цепи внутри глобулы - третичная структура, то есть взаимное расположение упорядоченных участков, изгибов между ними и неупорядоченных участков цепи, - весьма причудлив. Однако он полностью задается первичной структурой белковой цепи, то есть последовательностью аминокислотных остатков в цепи, и всегда одинаков у всех молекул данного белка в нативном состоянии.
