Синтез белков
Расщепление.
Расщепление в желудке (кислая среда).
Всасывание в тонком кишечнике.
 |  |
На нужды организма: CO2, Н2О, NH3 -выведение.
(аминокислоты выстраиваются в
различные последовательности).
![]()
![]()
![]() Жиры Углеводы.
Жиры Углеводы.
белки
(алиментарная дистрофия – необратимая)
Весь синтез белков состоит из двух процессов: транскрипции и трансляции.
1. Транскрипция – процесс считывания, синтез РНК, осуществляемый РНК полимеразой. Процесс идёт с одной цепи ДНК. Транскрипция производится одним или несколькими генами, отвечающих за синтез определённого белка. У прокариотов этот участок называется опероном.
2. В начале каждого оперона находится площадка для РНК полимеразы – промотр – специальная последовательность нуклеотидов РНК, которую фермент определяет благодаря химическому средству. Присоединяется к просмотру и начинается синтез иРНК. Дойдя до конца оперона фермент встречает сигнал (определённую последовательность нуклеотидов), который означает конец считывания.
Стадии процесса:
1. Связывание РНК полимеразы с промотором.
2. Инициация – начало синтеза.
3. Элонгация – рост цепочки РНК. V=50 нуклеотидов/секунда.
4. Терминация – завершение синтеза.
Трансляция – происходит в ядре на рибосомах.
Этапы:
1. Аминокислоты доставляют тРНК к рибосомам. Кодоны шифруют аминокислоты. На вершине тРНК имеется последовательность трёх нуклеотидов, компланарных нуклеотидам кодона в иРНК, - антикодон. Фермент определяет антикодон и присоединяет тРНК аминокислоту.
2. На рибосоме тРНК переводит с «языка» нуклеотидов на «язык» аминокислот. Далее аминокислоты отрываются от тРНК.
3. Фермент синтеза присоединяет аминокислоту к полипептидной цепи.
Синтез завершён и готовая цепь отходит от рибосом.
Строение белков.
Белки – это высокомолекулярные соединения, молекулы которых представлены двадцатью альфа – аминокислотами, соединёнными пептидными связями – СО - NН -
· Дипепетиды
· Полипептиды.
Мономерами белков являются аминокислоты.
Кислотные свойства аминокислот определятся карбоксильной группой (-СООН), щелочные – аминогруппой (-NH2). Каждая из 20 аминокислот имеет одинаковую часть, включающую обе эти группы (-CHNH2 – COOH), и отличается от любой другой особой химической группировкой R – группой, или радикалом.
Существуют:
· Простые белки – состоящие из одних аминокислот. Например, растительные белки – проламины, белки кровяной плазмы – альбулины и глобулины.
· Сложные белки – помимо аминокислот имеют в своём составе другие органические соединения (нуклеиновые кислоты, липиды, углеводы), соединения фосфора, металлы. Имеют сложные названия нуклеопротеиды, шикопротеиды и т. д.
Простейшая аминокислота – глицерин NH2 – CH2 – COOH.
Но разные аминокислоты могут содержать различные радикалы CH3 – CHNH2 – COOH
![]()
![]() H – O - - CH2 – CHNH2 – COOH
H – O - - CH2 – CHNH2 – COOH
Структура белков.
Образование линейных молекул белков происходит в результате соединения аминокислот друг с другом. Карбоксильная группа одной аминокислоты сближается с аминогруппой другой, и при отщеплении молекулы воды между аминокислотными остатками возникает прочная ковалентная связь, называемая пептидной.
Типы структур:
· Первичная – определяется последовательностью аминокислот. Из трёх аминокислот – 27 комбинаций, тогда из 20 аминокислот – 101300 длиной каждая не менее 100 остатков, следовательно, продолжается эволюционный процесс.
· Вторичная – спираль, полая внутри, которая удерживается водородными связями, при этом радикалы направлены наружу.
· 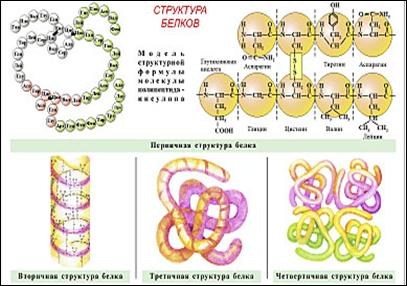 Третичная – физиологически активная структура, спираль, закрученная в клубок. Отрицательно и положительно заряженные R – группы аминокислот притягиваются и сближают участки белковой цепи, так образуется клубок, поддерживаемый сульфидными мостками (- S – S -).
Третичная – физиологически активная структура, спираль, закрученная в клубок. Отрицательно и положительно заряженные R – группы аминокислот притягиваются и сближают участки белковой цепи, так образуется клубок, поддерживаемый сульфидными мостками (- S – S -).
· Четвертичная структура – некоторые белки, например гемоглобин и инсулин, состоят из нескольких цепей, различающихся по первичной структуре.
В человеческом организме около 100000 белков, молекулярная масса которых от нескольких тысяч до нескольких миллионов.
История вопроса.
 В настоящее время строение и функции большинства белков известны. История изучения белков началась с исследования Беккари (1878г), который впервые из пшеничной муки выделил белковое вещество, названное им ''клековиной''.
В настоящее время строение и функции большинства белков известны. История изучения белков началась с исследования Беккари (1878г), который впервые из пшеничной муки выделил белковое вещество, названное им ''клековиной''.
 В 1888 г. А. Я. Данилевский предположил существование в белках -N-S- химических группировок.
В 1888 г. А. Я. Данилевский предположил существование в белках -N-S- химических группировок.
В 1902 г. Э. Фишер предложил пептидную теорию строения белка.
В 1951 г. Л. Полинг разработал модель вторичной структуры белка.
 В 1953 г. Сэнгер расшифровал аминокислотную последовательность в инсулине (гормон поджелудочной железы), а через 10 лет уже тот же инсулин был получен путем искусственного синтеза из аминокислот. Совершенствование методов исследования достигло такого уровня, что в настоящее время изучение структуры белковой молекулы является относительно простым делом и для большего количества белков установлено их строение (аминокислотный состав и аминокислотное строение).
В 1953 г. Сэнгер расшифровал аминокислотную последовательность в инсулине (гормон поджелудочной железы), а через 10 лет уже тот же инсулин был получен путем искусственного синтеза из аминокислот. Совершенствование методов исследования достигло такого уровня, что в настоящее время изучение структуры белковой молекулы является относительно простым делом и для большего количества белков установлено их строение (аминокислотный состав и аминокислотное строение).

Перспективы.
У белков очень сложное строение и на данном этапе развития науки очень сложно выявить структуру молекул белков.
Первый белок, у которого была расшифрована первичная структура, был инсулин. Это случилось в 1954 году. Для этого понадобилось около 10 лет. Синтез белков - очень сложная задача, и если ее решить, то возрастет количество ресурсов для дальнейшего использования их в технике, медицине и т.д., а также уже возможен биохимический и синтетический способы получения пищи.
А.Н. Несмеянов провел широкие исследования в области создания микробиологической промышленности по производству искусственных продуктов питания. Практическое осуществление путей получения такой пищи ведется в двух основных направлениях. Одно из них основано на использовании белков растений, например сои, а второе - на использовании белков продуктов, полученных микробиологическим путем из нефти.
