Синтез и анализ ХТС в производстве азотной кислоты
Содержание
Введение
1. Синтез ХТС
1.1. Литературная часть
1.2. Технологическая часть
1.2.1. Характеристика исходного сырья, вспомогательных материалов и готовой продукции
1.2.2. Модели рассматриваемой ХТС
- Химическая модель
- Технологическая схема
- Структурная модель
- Функциональная модель
- Операторная модель
2. Анализ ХТС
Заключение
Список используемых источников
ВВЕДЕНИЕ
Азотная кислота - один из важнейших продуктов химической промышленности. По объёму производства азотная кислота находится на втором месте после серной кислоты. Азотная кислота является сырьём для выработки многих продуктов, применяемых в промышленности и сельском хозяйстве. В нашей стране около 40% вырабатываемой азотной кислоты расходуется на производство сложных и азотных минеральных удобрений, нитратных солей (нитратов натрия, калия и кальция). Концентрированная азотная кислота применяется в производстве соединений ароматического ряда для синтеза красителей; в производстве взрывчатых веществ (нитроглицерина, продуктов нитрования толуола), уротропина, диметиланилина, ксилола; в фармацевтической промышленности; для получения нафталина, нитропроизводных бензола, химикатов для фотографии.
Сельское хозяйство потребляет соли азотной кислоты в качестве удобрений главным образом в виде нитрата аммония - аммиачной селитры, получаемой путём нейтрализации азотной кислоты аммиаком.
При получении удобрительных туков потребляется разбавленная азотная кислота, содержащая от 45% до 60% азотной кислоты.
В производстве взрывчатых веществ нитрованием толуола, уротропина, ксилола, нафталина и других органических продуктов применяют концентрированную азотную кислоту (96-98%). Для нитрования употребляют смеси азотной кислоты с концентрированной серной кислотой, которая связывает воду, выделяющуюся в процессе нитрования и замедляющая эту реакцию.
В качестве взрывчатых веществ применяют также аммониты - смеси аммиачной селитры с нитропроизводными ароматических соединений и некоторыми другими веществами.
Путем нитрования бензола, антрацена и других ароматических соединений получают полупродукты для производства синтетических красителей и ряда важных химикатов.
Большие количества азотной кислоты потребляются также в процессе получения серной кислоты нитрозным методом. В последнее время окислы азота и азотная кислота нашли применение в качестве окислительных компонентов ракетного топлива.
Основными потребителями азота являются химическая и металлургическая промышленность. Используют в борьбе с пожарами и для получения низких температур, а также в строительстве.
1. Синтез ХТС
1.1. Литературная часть
Производство неконцентрированной азотной кислот
До 50-х годов в производстве неконцентрированной азотной кислоты самой экономичной считалась схема, работающая под атмосферным давлением. Преимущество этого метода - в простоте оборудования, низком расходе электроэнергии, аммиака и платины. Однако для этой схемы характерны и значительные недостатки: высокие капитальные затраты на сооружение цехов, наличие щелочного поглощения остаточных оксидов азота, высокое содержание оксидов азота после щелочного поглощения и, кроме того, громоздкость оборудования и большой расход нержавеющей стали. В состав производства входят пять самостоятельных корпусов: контактное отделение, отделение абсорбции, склад неконцентрированной азотной кислоты, склад соды с содорастворением и цех натриевой селитры. Большое количество корпусов требует значительных капиталовложений на межцеховые коммуникации, увеличения штата обслуживающего персонала и т.д.
Государственный институт азотной промышленности разработал комбинированную схему получения неконцентрированной азотной кислоты в абсорбционном отделении под давлением 3,5·105 Па с новым контактным оборудованием и применением агрегатного принципа всего технологического процесса. Новый проект позволил сэкономить оборудование контактного отделения, поместить отделение абсорбции и склад продукции в одном корпусе, исключить щелочное поглощение хвостовых нитрозных газов. Обезвреживание выхлопных газов достигается за счёт низкотемпературной очистки с применением аммиака на ванадиевом катализаторе. Содержание оксидов азота после очистки в выхлопных газах не более 0,012%.
Созданная комбинированная система по всем технико-экономическим показателям значительно превосходит схему, работающую под атмосферным давлением. Однако ввиду постоянно растущей потребности в азотной кислоте была создана новая схема процесса получения неконцентрированной азотной кислоты под повышенным давлением 7,3·105 Па. Этот метод позволил повысить производительность агрегата, снизить капитальные затраты, стоимость тонны продукции, расход дефицитной нержавеющей стали и исключить потребление электрической энергии извне. Последнее достигается за счёт применения в схеме высокотемпературной очистки хвостовых газов от оксидов азота посредством разложения оксидов до N2 природным газом. Используемый для этой цели алюминиево-палладиевый катализатор обеспечивает температуры хвостовых газов под давлением 7,3·103 Па до 973-1023 К в результате выделения тепла при разложении оксидов до N2 за счёт высокой температуры газов, поступающих под давлением каталитической очистки на рекуперационную турбину, обеспечивается замыкание энергетического баланса агрегата [1,2].
Разработанная технологическая схема, работающая под повышенным давлением 7,3·103 Па, относится к типу энерготехнологических процессов, в которых невозможно разделение чистой технологии и энергетики, они взаимосвязаны и не могут существовать отдельно. Схема эффективна как по капитальным затратам, так и по эксплуатационным показателям. Однако применение давления при процессе конверсии аммиака до оксида азота примерно на 4% снижает степень конверсии по сравнению с окислением под атмосферным давлением, что ведёт к увеличению расхода аммиака.
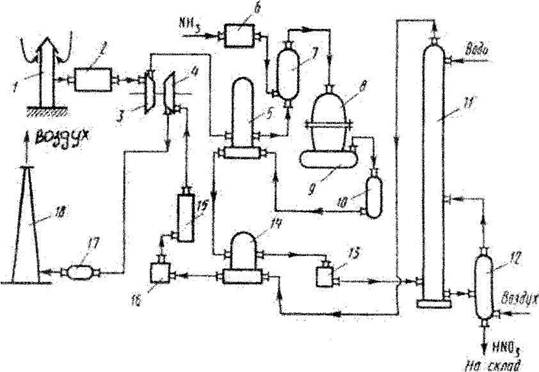
Рис. 1. Технологическая схема производства азотной кислоты
1-воздухозаборная труба; 2-воздухоочиститель; 3-газовый компрессор; 4-газовая турбина; 5-воздухоподогреватель; 6-испаритель аммиака; 7-смеситель с фильтром; 8-контактный аппарат; 9,17-котёл-утилизатор; 10-окислитель с фильтром; 11-абсорбционная колонна; 12-отдувочная колонна; 13-холодильник-конденсатор; 14-подогреватель хвостовых газов; 15-реактор каталитической очистки; 16-камера сгорания; 18-выхлопная труба.
Атмосферный воздух, забранный на территории завода, проходит тщательную очистку от возможных примесей, находящихся в воздухе, проходит воздухозаборную трубу 1 и воздухоочиститель 2. Очищенный атмосферный воздух поступает на всас компрессора газотурбинного агрегата. Сжатие происходит в осевом компрессоре 3, приводимый в движение газовой турбиной 4, до давления 0,73 МПа, нагреваясь при этом до 135°С , и поступает далее в подогреватель воздуха 5, где его температура поднимается до 250оС за счёт теплоты выходящих из окислителя 10 нитрозных газов. В смесителе 7 воздух смешивается с газообразным аммиаком, который поступает сюда из испарителя аммиака 6. Образовавшаяся аммиачно-воздушная смесь далее поступает в контактный аппарат 8, где при температуре около 900°С на Pt. - Rh - Pd -катализаторе происходит окисление аммиака. Нитрозные газы, содержащие 9 -9,5% N0, поступают в котёл-утилизатор 9, в котором происходит охлаждение до необходимой температуры и образование пара. Далее газы поступают в окислитель 10, в котором окисляются до диоксида азота. Охлаждённые в подогревателе воздуха 5, подогревателе хвостовых газов 14 и холодильнике-конденсаторе 13 до температуры около 45°С нитрозные газы поступают в абсорбционную колонну 11, орошаемую противоточно водой. Поскольку абсорбция NO2 водой экзотермична, абсорбционные тарелки снабжены змеевиковыми холодильниками, в которых циркулирует охлаждающая вода. Полученная азотная кислота самотёком поступает в отдувочную колонну 12, где с помощью горячего воздуха из готовой азотной кислоты происходит отдувка растворённых в ней нитрозных газов, которые подаются в абсорбционную колонну. Хвостовые газы, пройдя систему каталитической очистки от оксидов азота восстановлением их аммиаком до элементного азота в атмосферу.
