Синтез и свойства комплексов железа (II) и железа (III)
Образование хелатных структур характерно не только для комплексонов, но для других органических соединений. Например, очень устойчивы КС железа с бета-дикетонами. Простейший из бета-дикетонов железа – трисацетилацетонат Fe(AcAc)3 [14].
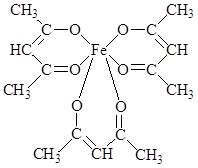
При нагревании сублимируется без разложения. В его молекуле имеются 3 шестичленных хелатных цикла. Несмотря на принадлежность к высокоспиновым соединениям, трисацетилацетонат железа (III) ведет себя как соединение с молекулярной структурой: ионная составляющая связи FeIII – лиганд экранируется углеводородными радикалами лиганда, в результате чего для соединения характерно слабое «органоподобное» межмолекулярное взаимодействие. Это объясняет его способность растворяться в малополярных растворителях и легко сублимироваться (150 0С).
В качестве неофициальных реакций наиболее чувствительным реактивом на железо (II) является спиртовой раствор диметилглиоксима, который образует с железа (II) ионом комплексное хелатное соединение красного цвета, нерастворимое в растворе аммиака [11]:
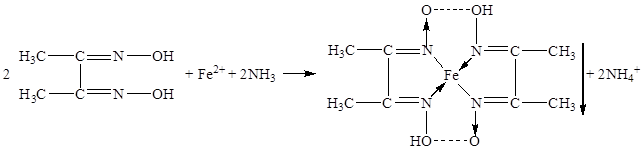
1.3.7. Нитропруссид натрия.
Производное гексацианоферрата (III) железа, называемое нитропруссидом натрия Na2[Fe(NO)+(CN)5]∙2H2O (кристаллы темно-красного цвета), можно получить, например, по реакции [14]:
Na3[Fe(CN)6] + NO = Na2[FeII(NO)+(CN)5] + NaCN
Таблица 3. Характеристика комплексных соединений железа.
|
Название |
Формула |
Валентность железа |
P |
Δ |
Спиновое состояние |
Схема расщепления d-орбиталей |
|
Тетрафтороферрат (II) |
[FeF4]2- |
2 |
209,9 |
106,2 |
ВС |
|
|
Нитропруссид |
[Fe(NO)(CN)5]2- |
2 |
209,9 |
НС |
| |
|
Гексаакважелезо (II) |
[Fe(H2O)6] 2+ |
2 |
209,9 |
124,1 |
ВС |
|
|
Комплекс с диметилглиоксимом (ДМГ) |
[Fe(C2(CH3)2N2OH(OH))2] |
2 |
209,9 |
НС |
| |
|
Гексаамминжелезо (II) |
[Fe(NH3)6]2+ |
2 |
209,9 |
153,9 |
ВС |
|
|
гексацианоферрат(II) |
[Fe(CN)6]4- |
2 |
209,9 |
403,2 |
НС |
|
|
гексацианоферрат(III) |
[Fe(CN)6]3- |
3 |
357,9 |
417,6 |
НС |
|
|
Дитиосульфатоферрат (III) |
[Fe(S2O3)2]- |
3 |
357,9 |
ВС |
| |
|
Дифосфатоферрат (III) |
[Fe(PO4)2]3- |
3 |
357,9 |
ВС |
| |
|
Триоксалатоферрат (III) |
[Fe(C2O4)3]3- |
3 |
357,9 |
ВС |
| |
|
Комплекс с ЭДТА |
[Fe(ЭДТА)H2O]- |
3 |
357,9 |
НС |
|
2. Практическая часть
2.1 Синтезы комплексов
2.1.1 Синтез триоксалатоферрата (III) калия
Вначале необходимо приготовить оксалат бария, для чего к раствору 1,5 г оксалата натрия в 40 мл воды прилить раствор 2,5 г дигидрата хлорида бария в 6 мл воды. Выпавшие кристаллы отфильтровать на воронке Бюхнера и промыть несколько раз холодной водой [7].
Для получения триоксалатоферрата (III) калия в стакан емкостью 50-100 мл поместить 1,25 г сульфата железа (III), полученный оксалат бария, 1,5 г оксалата калия и 30 мл воды. Нагревать смесь в течение нескольких часов на водяной бане, поддерживая постоянный объем. После отделения осадка сульфата бария упарить фильтрат до объема 5 мл и охладить. Кристаллы триоксалатоферрата (III) калия отфильтровать, промыть небольшим количеством воды, а затем спиртом и высушить в вакуум-эксикаторе над серной кислотой. Препарат следует защищать от солнечного света, сушку лучше производить в темном месте.
