Синтез нитрата адмантана
СОДЕРЖАНИЕ:
1. Введение
2. Литературный обзор
3. Экспирементальная часть
4. Выводы
5. Библиографический список
Открытие. Получение.Адамантан был открыт в 1933г. чехословацкими исследователями С. Ландой и В. Махачеком при исследовании состава нефти Годонинского месторождения. Из тонны этой нефти было выделено несколько граммов тугоплавкого, но летучего вещества, представляющего собой белый порошок. Были установлены состав и строение открытого углеводорода. Ученые дали ему название "Адамантан", которое сразу же привилось. Казалось совершенно несомненным, что адамантан, как и все насыщенные циклические углеводороды, будет устойчив к действию большинства реагентов, например окислителей. Но малая доступность нового вещества не позволила провести масштабные исследования его свойств.В 1957 г. американский химик П. Шляйер обнаружил, что при обработке гидрированного дициклопентадиена хлоридом или бромидом алюминия с выходом 12% образуется адамантан.  А исходное соединение получается крайне просто, в две стадии, из широко распространенного химического реактива – циклопентадиена.Через 3 года фирма "Дюпон" взяла патент на сходный процесс, в результате которого адамантан образуется уже с выходом 42%. После того, как адамантан стал доступен, начались исследования его химических свойств.
А исходное соединение получается крайне просто, в две стадии, из широко распространенного химического реактива – циклопентадиена.Через 3 года фирма "Дюпон" взяла патент на сходный процесс, в результате которого адамантан образуется уже с выходом 42%. После того, как адамантан стал доступен, начались исследования его химических свойств.
Структура.
Адамантан – трицикличесий мостиковый углеводород состава С10H16, молекула которого состоит из трех циклогексановых колец; пространственное расположение атомов углерода в молекуле адамантана то же, что и в кристаллической решетке алмаза. Согласно систематической номенклатуре, адамантан следует называть – трицикло [3.3.1.13,7] деканом.
Обычно адамантан изображают одним из следующих способов:
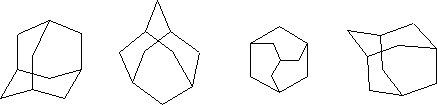
В органической химии существует небольшое число веществ, которые вызывали громадный интерес химиков всего мира. Среди подобных соединений – структуры бензола, ферроцена, карборана, фуллеренов и адамантана, есть и другие молекулярные структуры, вызывавшие и вызывающие интерес химиков-органиков. Вероятно, это во многом обусловлено необычностью структуры самих молекул, особенно высокой степенью их симметрии. Строение адамантана. Углеродный скелет молекулы адамантана подобен структурной единице алмаза.
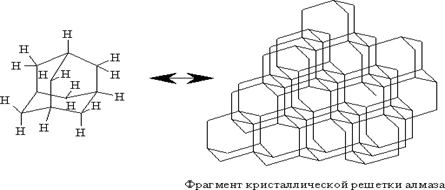
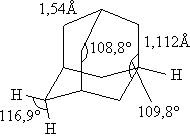
Именно поэтому название «адамантан» произошло от греческого «adamas» – алмаз. Экспериментально полученные структурные характеристики адамантана:
Подобная структура сохраняется практически у всех производных адамантана, что обусловлено высокой устойчивостью адамантанового каркаса. Адамантан – родоначальник гомологического ряда семейства углеводородов алмазоподобного строения диамантана, триамантана и т.д.:
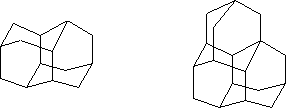
На основе химии адамантана возникла и развилась одна из областей современной органической химии – химия органических полиэдранов.
Применение. Сейчас синтезировано более тысячи разнообразных производных адамантана, многие из которых представляют не только теоретический, но и практический интерес. Например, радикал адамантил пытаются ввести в молекулы различных лекарственных веществ, в результате чего лекарственные вещества приобретают новые свойства. К лекарствам - производным адамантана относятся:1) Ремантадин (1-адамантил-1-этиламина гидрохлорид):Представляет собой белый кристаллический порошок, горький на вкус. Является специфическим химиотерапевтическим препаратом, оказывающим профилактическое действие в отношении гриппозной инфекции, вызванной штаммами вируса типа А2.2) Адапромин ( 7a 0-Пропил-1-адамантил-этиламина гидрохлорид).По химической структуре и действию близок к Ремантадину, но эффективен в отношении вирусов гриппа А и В.3) Мидантан (1-Аминоадамантана гидрохлорид):Препарат был первоначально предложен в качестве противовирусного средства, эффективного в отношении вирусов гриппа типа А2. В дальнейшем была обнаружена его активность при паркинсонизме, для лечения чего он сейчас и применяется.4) Глудантан (Глюкуронид 1-аминоадамантана):Сходен по действию с Мидантаном, эффективен при паркинсонизме разл. этиологии, в частности при нейролептическом и посттравматическом синдроме. Введение в молекулу препарата глюкуронидного радикала несколько уменьшает его токсичность по равнению с Мидантаном и улучшает его прохождение через гематоэнцефалический барьер.Содержащие адамантан полимеры обладают высокими т-рами стеклования и размягчения, низкой усадкой, прозрачностью и применяются в производстве оптических стекол. Высоковязкие растворы полиадамантилакрилатов - загустители смазочных масел. Алкил замещенные адамантана используются в качестве добавки к топливам для повышения октанового числа.
ОБЩАЯ ХАРАКТЕРИСТИКА НИТРАТОВ СПИРТОВ
Нитраты спиртов, или нитроэфиры, составляют основу бездымных порохов и твердых ракетных топлив, а также входят в состав многих промышленных взрывчатых веществ (динамитов, победитов, некоторых аммонитов и др.) [1]. Ассортимент используемых для вооружения и промышленных целей нитроэфиров, который долгое время ограничивался нитроглицерином и пироксилином, все время расширяется. Широкому применению нитроэфиров в технике, несмотря на их высокую чувствительность к механическим воздействиям и относительно низкую стойкость, способствует легкость получения, доступность исходных материалов и высокие взрывчатые свойства. Многие нитроэфиры способны пластифицировать высокомолекулярный нитроэфир — нитроцеллюлозу. Такая пластификация, приводящая к образованию эластичных масс с хорошими физико-механическими показателями, используется при производстве высокоэнергетического баллиститного пороха.
Некоторые нитроэфиры, например тетранитрат пентаэритрита (тэн), благодаря высокой чувствительности к детонационному импульсу и малому критическому диаметру детонации, используют для снаряжения капсюлей-детонаторов, детонирующих шнуров и детонаторов.
По свойствам нитроэфиры резко отличаются от нитросоединений и нитраминов, вследствие того, что нитрогруппа связана с углеродом через кислород —С—О—NO2. Эту группировку атомов называют нитратной, а нитроэфиры рассматривают как О-нитросоединения.
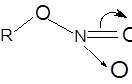 Атомы С, О и N нитратной группировки лежат в одной плоскости, и кратность связи нитрогруппы с кислородом несколько больше единицы, о чем говорит высокий барьер вращения (~ 10ккал/моль) вокруг этой связи:
Атомы С, О и N нитратной группировки лежат в одной плоскости, и кратность связи нитрогруппы с кислородом несколько больше единицы, о чем говорит высокий барьер вращения (~ 10ккал/моль) вокруг этой связи:
Спектроскопические исследования различных Нитроэфиров подтверждают симметричность структуры нитратной группировки. Длины связей и углы между ними следующие :
![]()
Доказательством связи нитрогруппы с кислородом является реакция восстановления нитроэфиров, приводящая к образованию исходного спирта и аммиака:
