Синтез тиоцианата ртути
* - с разложением. [7]
Тиоцианат аммония (NH4NCS) - водорастворимые бесцветные кристаллы, расплывающиеся на воздухе, на свету и на воздухе приобретают красную окраску, при нагревании разлагаются.
Тиоцианат натрия (NaNСS) – бесцветные гигроскопические кристаллы с ромбической решоткой. Ядовит.
Тиоцианат калия (KSCN) – водорастворимый белый порошок, при плавлении приобретает синеватый оттенок, а при остывании снова становится белым.
Тиоцианат одновалентной меди (CuSCN) - беловатый, сероватый или желтоватый порошок или паста не растворимый в воде.
Тиоцианат двухвалентной меди (Cu(SCN)2) - черный порошок, не растворимый в воде, легко превращается в тиоцианат одновалентной меди.
Тиоцианат кальция (Ca(SCN)2*3H2O). Бесцветные кристаллы, расплывающиеся на воздухе и растворимые в воде.[8]
Наличие в тиоцианатном ионе атомов серы и азота, находящихся в промежуточных степенях окисления, обуславливает его способность проявлять как окислительную, так и восстановительную активность в химических реакциях:
2KNCS + I2 = KI+ (SCN)2 (ок-ные свойства)
KNCS + 10KOH + 8KMnO4 = KOCN + 8K2MnO4 + K2SO4 + 5H2O (вост-ные свойства)
В водных растворах все тиоцианаты окисляются О2 до сульфатов, взаимодействуют с Сl2 и Br2 с образованием циангалогенидов, восстанавливают Fe до цианидов металлов.
Получают тиоцианаты из цианатов металлов и S, обменной реакцией сульфатов или нитратов металлов с тиоцианатами Ba или Na, взаимодействием гидроксидов или карбонатов металлов с HCN. Наиболее характерны реакции - окисление, восстановление, галогенирование, а также обменные реакции с другими тиоцианатами. Например:
3NH4NCSк + 2Н2O = H2C2N2S3 + 2(NH3*H2O) + NH4CN
2NH4NCSр + I2 = 2NH4I + (SCN)2
KNCS + Fe = KCN + FeS
2KNCS + Pb(NO3)2 = Pb(SCN)2 + 2KNO3
Тиоцианаты щелочных металлов и аммония разлагаются при нагревании, например:
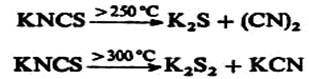
Термическая изомеризация NH4NCS положена в основу промышленного получения тиомочевины:
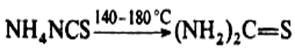
Токсичность тиоцианатов сравнительно невелика (например: KNCS раздражает кожу, при длительном воздействии угнетает щитовидную железу, поражает почки; NH4NCS вызывает явление ксантопсии, т. е. видение предметов в желтом цвете). Токсичность других тиоцианатов, например Pb(SCN)2 или Hg(SCN)2, во многом определяется физиологическим воздействием входящих в них металлов. Тиоциановая кислота содержится в соке лука Allium соера и в корнях других растений. Тиоцианаты в небольших количествах найдены в слюне и в желудочном соке животных. В слюне человека содержится в среднем 0,01% SCN-, в крови около 1,3 мг в 100 мл в виде KNCS.
2.4.2 Получение тиоцианатов
Основные методы получения HNCS – это взаимодействие (Э)NCS с KHSO4 или ионный обмен водных растворов NH4NCS (получают нагреванием смеси аммиака и сероуглерода). Родан или тиоциан обычно получают по реакциям:
Cu(SCN)2 = CuSCN + 0,5(SCN)2
Hg(SCN)2 + Вr2 = HgBr2 + (SCN)2
Тиоцианаты щелочных металлов и аммония получают при улавливании цианистых соединений, содержащихся в коксовом газе, растворами соответствующих полисульфидов. Кроме того, NH4NCS получают взаимодействием NH3 с CS2, a KNCS и NaNCS получают сплавлением KCN или NaCN с серой.
KCN + S = KSCN(сплавление)
Другие тиоцианаты синтезируют обменной реакцией сульфатов, нитратов или галогенидов металлов с тиоцианатом Ba, К или Na:
KSCN + AgNO3 = AgSCN + KNO3
или взаимодействием гидроксидов или карбонатов металлов с HNCS:
HSCN + NaOH = NaSCN + H2O
CuSCN получаются из тиоцианатов щелочных металлов, гидросульфита натрия и сульфата меди. Ca(SCN)2*3H2O получают действием оксида кальция на тиоцианат аммония.
2.4.3. Комплексные соединения тиоцианатов
Тиоцианаты образуют комплексные соединения, в которых металл в зависимости от донорно-акцепторных свойств лиганд может координироваться как по атому N, так и по атому S. [9]
Hg(ΙΙ) образует тригональные комплексы тиоцианата ртути с пнитробензоилгидразином (L). Взаимодействием соответствующего Hg(SCN)2 c пнитробензоилгидразином и сплавлении при температуре 50-600С были получены HgL(SCN)2. Экспериментально установлено, что данное вещество не растворимо в большинстве органических растворителях, умеренно растворимы в MeCN, причем их растворы не являются электролитами. В спектре HgL(SCN)2 проявляются полосы C-N, C-S и C-S, что указывает на кольцевой характер группы SCN и ее координацию с Hg2+ через атом S. Исходя из того, что лиганд L монодентантен, а группа SCN кольцевая был сделан вывод, что нейтральный Hg(SCN)2 имеет мономерное трехкоординационное строение. [10]
2.4.4 Применение тиоцианатов
Тиоцианаты используют в промышленности. NH4SCN используется в гальваностегии, в фотографии, при крашении и набивке тканей (в частности, для сохранения свойств шелковых тканей), для приготовления охладительных смесей, для получения цианидов и гексацианоферратов (II), тиомочевины, гуанидина, пластмасс, адгезивов, гербицидов.
NaSCN используется в фотографии, как протрава при крашении и набивке тканей, в медицине, как лабораторный реагент, в гальваностегии, для приготовления искусственного горчичного масла, в резиновой промышленности.
KSCN используется в текстильной промышленности, в органическом синтезе (например, для получения тиомочевины, искусственного горчичного масла или красителей), для получения тиоцианатов, охлаждающих смесей, инсектицидов.
Ca(SCN)2*3H2O применяется как протрава при крашении или набивке тканей и как растворитель для целлюлозы, для мерсеризации хлопка, в медицине вместо иодида калия (для лечения атеросклероза), для получения гексацианоферратов (II) или других тиоцианатов, при изготовлении пергамента.
CuSCN используется как протрава при набивке текстильных изделий, для изготовления красок ("marine paints") и в органическом синтезе; Cu(SCN)2 используется для приготовления детонирующих капсул и спичек. Они используются и в аналитической химии в качестве реагентов в роданометрии и меркуриметрии.[8]
Тиоцианатные комплексы используют в фотометрическом анализе для определения Со, Fe, Bi, Mo, W, Re, в технологии редких металлов для разделения Zr и Hf, Th и Ti, Ga и Аl, Та и Nb, Th и La, для получения спектрально чистого La. Тиоцианаты Nb(V) и Ta(V) являются катализаторами в реакции Фриделя – Крафтса. [9]
