Синтез хлороформа. Реакции нуклеофильного замещения и элиминирования галогеналканов
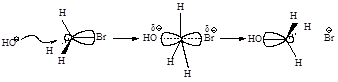
а б в
Рис.2.1. Бимолекулярное нуклеофильное замещение:а - исходные соединения: заряд локализован на атоме кислорода; б - переходное состояние (активированный комплекс), отрицательный заряд распределен между атомом кислорода и атомом брома; в - продукты реакции
Энергетическая диаграмма реакции (рис. 2.2) изображает изменение потенциальной энергии в ходе реакции нуклеофильного замещения.
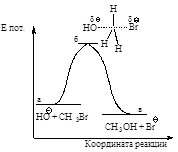
Рис.2.2. Диаграмма изменения потенциальной энергии в реакции бимолекулярного нуклеофильного замещения, SN2 - процесс согласованный одностадийный: а - энергия исходных веществ, б - энергия переходного состояния, в - энергия продуктов реакции.
Скорость реакции. Гидролиз бромистого метила является реакцией второго порядка, скорость его зависит от концентрации двух веществ и определяется по формуле V = K [R-Hal] [Nu]. Термин «бимолекулярное замещение» означает, что в скорость определяющей стадии участвуют две частицы. Поскольку разрыв связи углерод-уходящая группа и образование связи нуклеофил-углерод происходят одновременно, бимолекулярное нуклеофильное замещение называют согласованным процессом.
Концентрация нуклеофильного реагента. Высокая концентрация нуклеофила увеличивает скорость SN2- реакции.
Растворитель. Выбор растворителя диктуется следующимиусловиями:
а) достаточно хорошая растворимость реагентов,
б) лучшая сольватация переходного состояния по сравнению с исходными соединениями,
в) предотвращение побочных реакций.
Реакции, в которых из нейтральных молекул образуется полярное переходное состояние, значительно ускоряются при увеличении полярности растворителя: более полярный растворитель в большей степени стабилизирует полярное переходное состояние, чем исходную систему (рис.2.3.а).
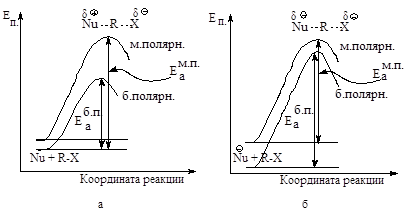
Рис.2.3. Влияние полярности растворителя на скорость SN2: а - повышение полярности растворителя стабилизирует АК в большей степени, чем исходное соединение, энергия активации уменьшается, скорость реакции увеличивается, б - повышение полярности растворителя стабилизирует исходную систему в большей степени, чем АК, энергия активации увеличивается, скорость реакции уменьшается.
Если в исходной системе имеется нуклеофил с полным отрицательным зарядом, то этот заряд стабилизируется в определенной степени в результате электростатического притяжения между молекулами полярного растворителя и ионом Nu- .
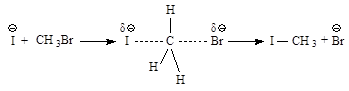
В активированном комплексе заряд распределен между атомом, образующим новую связь, и уходящей группой. Полярный растворитель будет стабилизировать и активированный комплекс и исходное состояние. Увеличение полярности растворителя несколько замедлит реакцию, так как замена менее полярного растворителя на более полярный увеличит в большей степени стабильность исходного соединения, в меньшей - активированного комплекса (рис. 2.3, б).
Наиболее подходящими для синтеза соединений и изучения механизма SN2 являются апротонные биполярные растворители, т.е. растворители с высокой диэлектрической проницаемостью, но не способные к образованию водородных* связей:
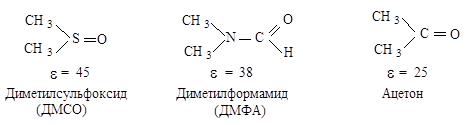
Апротонные растворители не могут сольватировать анионы за счет образования водородных связей с ними и химики называют их «голыми». Биполярные апротонные растворители особенно необходимы для осуществления реакций SN2 в случае применения малоактивных нуклеофилов. В реакции бромэтана (SN2) с гидроксиданионом лучшим растворителем является водный раствор этанола с массовой долей 80%; добавление воды к этанолу служит для предотвращения побочной реакции отщепления бромоводорода.
Уходящие группы. «Хорошими» уходящими группами являются те группы, которые, оторвавшись от атома углерода, образуют устойчивые анионы. Сильные основания являются обычно «плохими» уходящими группами, слабые основания - «хорошими» уходящими группами.
![]()
В этом ряду сила основания увеличивается, а способность быть хорошей уходящей группой уменьшается. Наилучшими уходящими группами являются ионы - сопряженные основания* сильных кислот, так как они являются очень слабыми основаниями (отрицательный заряд распределен).
*Водородная связь - связь между молекулами за счет электростатического притяжения между сильно протонированным атомом водорода одной молекулы и электроотрицательным атомом другой молекулы. Для образования водородной связи необходимо, чтобы электроотрицательными атомами были F, O, N.
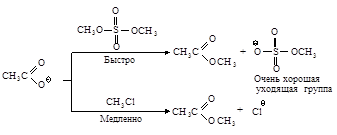
Cтереохимия. Бимолекулярное нуклеофильное замещение протекает с полным обращением конфигурации, т.е. происходит обращение каждой реагирующей молекулы.
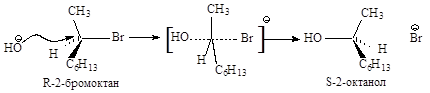
Конфигурация исходного 2-бромоктана при атаке хирального атома углерода с тыла меняется на противоположную, молекула субстрата выворачивается. Полное обращение конфигурации хирального углерода может служить доказательством SN2-механизма.
Обозначение конфигурации: Для этой цели наиболее широко используют символы R и S. Эта система обозначений предложена Р. Каном (Химическое общество, Лондон), К. Ингольдом (Университетский колледж, Лондон) и В. Прелогом (Федеральная высшая техническая школа, Цюрих).
Согласно этой системе, сначала определяют старшинство, или последовательность, заместителей, т. е. четырех атомов или групп, связанных с асимметрическим атомом углерода, исходя из правила старшинства.
Правило старшинства 1. Если с асимметрическим атомом углерода связаны четыре различных атома, то старшинство зависит от атомного номера, причем более старшим будет атом с большим атомным номером.
Если два атома являются изотопами одного элемента, то преимущество имеет атом с большим массовым числом. Например, в хлориодметансульфо- кислоте атомы, согласно их старшинству, располагаются в следующей последовательности: I > С1 > S > Н; в a-дейте-роэтилбромиде — Вг > С > О > Н.
*Всякое основание и кислота, между которыми существует соотношение называются сопряженными. Чем сильнее кислота, тем слабее сопряженное основание.
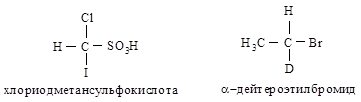
Правило старшинства 2. Если относительное старшинство групп нельзя определить с помощью правила 1, то необходимо провести аналогичное сравнение для следующих атомов в группах (и так далее, если необходимо, двигаясь дальше от асимметрического атома углерода). Иначе говоря, если асимметрический атом углерода связан с одинаковыми атомами, то следует сравнить заместители, связанные с каждым из этих первых атомов. Например, рассмотрим втор-бутилхлорид, в котором с асимметрическим атомом углерода связаны два углеродных атома. В СН3-группе следующими атомами являются Н, Н и Н; в С2Н5-группе – С, Н, Н.
