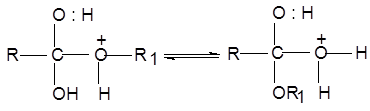Синтез этилового эфира 4-бромбенозойной кислоты
|
Скорость этой реакции возрастает от первичных к третичным спиртам, причем она также зависит от галогена: наибольшей она является для иода, наименьшей – для хлора.
1.2.3. Дегидратация спиртов (отщепление воды).
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:
|
|
![]() СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
СН3-СН2-СН2ОН СН3-СН=СН2+Н2О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
|
|
|
![]() 2С2Н5ОН С2Н5-О-С2Н5+Н2О
2С2Н5ОН С2Н5-О-С2Н5+Н2О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
1.2.4. Дегидрогенизация спиртов и окисление.
Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный спирт превращается в альдегид, вторичные спирты дают в этих условиях кетоны.
|
|
|
|
третичные спирты в тех же условиях не дегидрируются.
Такое же различие проявляют первичные и вторичные спирты при окислении, которое можно проводить "мокрым" путем, например, действием хромовой кислоты, или каталитически, причем катализатором окисления служит также металлическая медь, а окислителем кислород воздуха:
RCH2OH + O ® R-COH + H2O
 |  |
CHOH + O ® C=O + H2O
1.2.5. Замещение гидроксильной группы спирта водородом.
Спирты устойчивы к действию химических восстановителей. Они не восстанавливаются и водородом над катализатороми. Поэтому спирты применяют в качестве растворителей или доноров при восстановлении других соединений.
Метод непрямого восстановления спиртов действием йодистоводородной кислоты:
![]()
1.2.6 Окисление.
Окисление первичных спиртов в альдегиды и вторичных спиртов в кетоны является одним из важнейших превращений функциональных групп и оценкой избирательного действия реагента, используемого в качестве окислителя.
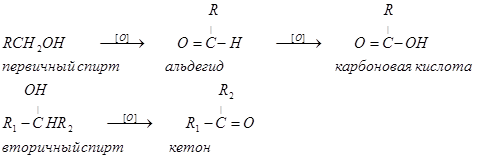
Третичные спирты не окисляются, а в жестких условиях окисление сопровождается деструкцией углеродного скелета. Наиболее широкое применение для окисления спиртов нашли реагенты на основе переходных металлов - хрома (VI), марганца (VII), марганца (IV).
1.2.7 Образование сложных эфиров спиртов .
Механизм реакции этерификации:
1) Присоединение протона, образование гидроксониевого иона:
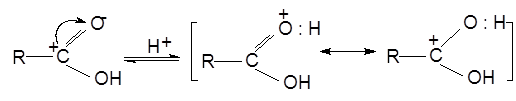
2) Катион взаимодействует с молекулой спирта по не поделенной электронной паре атома кислорода, образуя оксониевый ион:
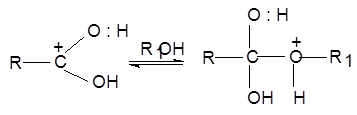
3) Происходит перегруппировка оксониевого иона: