Сложные реакции. Типы реакций
Под сложными реакциями подразумевают такие реакции, при которых в системе протекает не одна, а несколько (минимум две) реакции с участием тех же реагирующих веществ. В числе сложных реакций следует назвать: обратимые реакции различных порядков, параллельные реакции различных порядков, последовательные реакции (консекутивные), сопряженные. Сюда же можно отнести цепные и фотохимические реакции.
В основе кинетики сложных реакций лежит принцип независимости различных реакций. По этому принципу, если в системе протекает несколько реакций, каждая из них протекает независимо от другой, и каждая подчиняется закону действия масс. Полное изменение системы является суммой изменений, внесенных всеми этими независимыми реакциями. Математически это означает, что кинетическое уравнение сложной реакции является алгебраической суммой кинетических уравнений составляющих её простых решений. Принцип независимости не безусловно общий, т.к. известно взаимовлияние реакций, например, в случае сопряженных реакций. Во многих случаях принцип независимости подтверждается опытом и его применение оказывается полезным и плодотворным.
Обратимые р-ии
Пусть обратимая реакция ![]() имеет первый порядок в обоих направлениях. Обозначим через a и b – начальные концентрации, а через х – уменьшение концентрации исходного вещества к моменту времени τ или количество прореагировавшего вещества.
имеет первый порядок в обоих направлениях. Обозначим через a и b – начальные концентрации, а через х – уменьшение концентрации исходного вещества к моменту времени τ или количество прореагировавшего вещества.
В соответствии с принципом независимости суммарная наблюдаемая скорость реакции есть сумма независимых скоростей прямой и обратной реакций, т.е.
![]() (1)
(1)
Такие реакции, в отличие от необратимых, доходят в пределе, когда ![]() , не до конца, когда
, не до конца, когда ![]() , а до состояния равновесия, при котором общая скорость реакции равна нулю.
, а до состояния равновесия, при котором общая скорость реакции равна нулю.
![]() (2)
(2)
здесь ![]() - изменение концентрации исходного вещества, соответствующее равновесию; его количество, вступившее в реакцию к моменту наступления равновесия.
- изменение концентрации исходного вещества, соответствующее равновесию; его количество, вступившее в реакцию к моменту наступления равновесия.
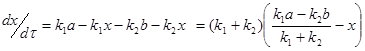 (3)
(3)
Приравнивая выражение ![]() к нулю, что соответствует равновесию, получим:
к нулю, что соответствует равновесию, получим:
![]() , откуда
, откуда
![]() (4)
(4)
Подставляя (4) в (3):
![]() (5)
(5) 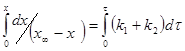
![]() (6)
(6)
Полученное уравнение (6) имеет сходство с уравнением для необратимой реакции 1-го порядка. Разница в том, что в полученном уравнении вместо начальной концентрации стоит величина ![]() , а в правой части уравнения мы имеем сумму констант прямой и обратной реакции.
, а в правой части уравнения мы имеем сумму констант прямой и обратной реакции.
Каждую из констант k1 и k2 можно вычислить, если провести термодинамический расчет и определить ![]() . По величине
. По величине ![]() можно вычислить равновесные концентрации и
можно вычислить равновесные концентрации и ![]() . Т.о., экспериментально определяя х для какого-либо τ, можно вычислить каждую из констант k1 и k2.
. Т.о., экспериментально определяя х для какого-либо τ, можно вычислить каждую из констант k1 и k2.
Параллельные р-ии
Очень часто, особенно в органической химии, исходные вещества реагируют сразу по нескольким направлениям, причем в каждом – со своей скоростью. Например, при нитровании фенола получаются три изомера: орто-, мета-, и пара-. Или при разложении бертолетовой соли:
![]()
Рассмотрим простейший случай двух параллельных необратимых реакций первого порядка:
![]() , где:
, где:
а – начальная концентрация вещества А,
х – количество вещества А, вступившего в реакцию к моменту времени τ,
х1 – количество вещества А, вступившего в реакцию по направлению 1,
х2 – количество вещества А, вступившего в реакцию по направлению 2.
х= х1+ х2 (1)
![]() ;
; ![]() (2);
(2);
![]() (3)
(3)
![]() (4);
(4);
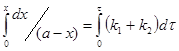
![]() (5)
(5)
Уравнение (5) похоже на уравнение, полученное для необратимой реакции 1-го порядка.
Экспериментально определяя х для какого-то τ по уравнению (5), вычисляем сумму констант скоростей ![]() . Для вычисления каждой константы в отдельности необходимы дополнительные условия:
. Для вычисления каждой константы в отдельности необходимы дополнительные условия:
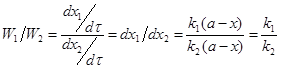
![]() ;
;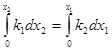 ;
;![]() ;
;![]() (6)
(6)
Отношение количеств исходного вещества, вступивших в реакцию в том и другом направлении, в течение всего процесса постоянно.
Используя уравнения (6) и (5), можно вычислить каждую из констант в отдельности. Рассмотрим случай двух параллельных необратимых реакций 2-го порядка.
![]() , где: а и b – концентрации исходных веществ,
, где: а и b – концентрации исходных веществ,
х – убыль концентрации одного из реагирующих веществ.
![]()
![]() ,
,
Аналогично полученному ранее для необратимой реакции 2-го порядка.
Последовательные р-ии
Такие р-ии очень часто встречаются в органической химии. Р-ия протекает через ряд последовательных стадий. Промышленные вещества могут состоять из обычных молекул в дальнейшем вступивших в р-ию либо представляющие свободные атомы или радикалы, обладающие повышенной хим. активностью в подавляющем большинстве случаев. Механизм такой многоступенчатой р-ии неизвестен, поэтому составляют вероятностную схему протекания р-ии по стадиям, опираясь на эту схему, получаю общее кинетическое уравнение суммарной р-ии. Если это уравнение согласуется с опытными данными, то предложенный механизм р-ии является вероятным, но не достоверным. Так как не исключена возможность др. схемы протекания р-ии, которая приведёт к такому же кинетическому уравнению. Точное математическое решение уравнения полученного для последней р-ии с использованием основных законов кинетики целесообразно лишь в простых случаях. В более сложных случаях, если оно вообще возможно приводит к громоздкой формуле, что практически использовать в лучшем случае затруднительно. Рассмотрим решение самого простого случая 2-ух последних односторонних реакций 1-ого порядка, т. е. обозначим а – начальную концентрацию А, х – убыль концентрации исходного вещества А к моменту времени или его количество вступившее в р-ию к моменту времени – количество образовавшегося к моменту времени вещества с (количество вступившего в р-ию вещества В), тогда к моменту концентрации реагирующих веществ будут равны. Концентрации. Скорость первой стадии интеграла. Скорость образования продуктов р-ии. Учитывая ур. 1 можно записать. Полученное Ур. 3 является диф ур. типа ур Лейбница. Решение этого Ур даёт следующие формулы, может быть получено с учётом ур 4, 1. графически интерпретация Ур 4,5,1 приводит к следующему.
