Современная трактовка таблицы Менделеева
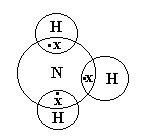
1. Химическая связь образуется парой электронов с противоположными спинами, которые локализованы между двумя атомами.
2. Число связей, образованным данным атомом равно числу неспаренных частиц (ЭЛ-В) в основном и неспаренном состоянии.
 |
3. ![]() свойство молекул опр.
свойство молекул опр. ![]() свойства связи.
свойства связи.
4. Направленность валентности определяется ортогональностью орбиталей (расположенностью).
5. Валентно насыщенные молекулы могут образовывать соединения за счет донорного акценторного взаимодействия (наличие валентной Атомной Орбитали и не поделенной пары электронов).
Направленность спинов:
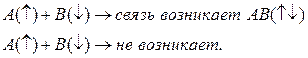
 |
Под ней понимается та энергия, которая выделяется в результате взаимодействия данных атомов , участвующих в реакции.
Если соединение двух атомов;
![]()
m0- атомарная энергия обр. (тепловой эффект ), есть энергия связи
![]()
![]() Пример:
Пример: 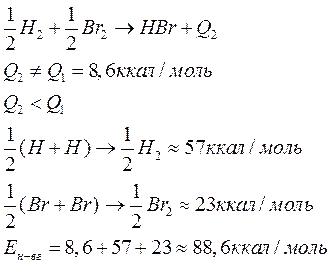
1.6 Метод молекулярных орбиталей:
Характеристики:
1. Молекула рассматривается как целое, а не как совокупность сохраняющих индивидуальность атомов (индивидуальные характеристики).
1.2 Каждый электрон принадлежит целой молекуле и движется в поле ядер.
2. Состояние электрона в молекуле описывается молекулярной орбиталью, которая характерна набором квантовых чисел
2.1 Молекулярная орбиталь многоцентровая.
3.Каждой молекулярной орбитали соответствует своя энергия, которая ![]() потенциалу ионизации данной орбитали.
потенциалу ионизации данной орбитали.
Совокупность молекулярных орбиталей молекулы называют её эл конфигураций, в основе которой лежат два принципа:
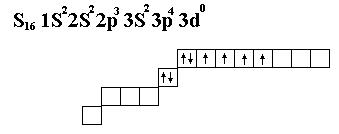
1. Принцип наименьшей энергии.(электроны занимают орбиты с наименьшей энергией).
2. Принцип Паули.(на одной молекулярной орбитале не может быть больше двух электр с антипаралельными спинами).
Движение электр в молекуле рассматривается как взаимодействие.
Электронная энергия молекул есть сумма энергий орбиталей за вычетом суммы энергий межэлектродного отталкивания + сумма энергий отталкивания между ядрами.
![]()
Направленность ковалентных связей.
Виды ковалентных связей:
1. Ионная
2. Ковалентная
3. Металлическая
4. Водородная связь обусловлена силой Вандервальса, при взаимодействии атомы, которые вступают в связь, сильно отличны по электроотрицательности.
K и F
Na и Cl [Na+] + [Cl-] ![]() Na+Cl-
Na+Cl-
Na – e![]() Na+
Na+
Cl + e![]() Cl-
Cl-
Взаимодействие осуществляется за счёт сил электростатического взаимодействия. За счёт перераспределения электроны образуют те или иные связи.
(2) Связь возникает между атомами, незначительно различными по энергии электроотрицательности. Практически отсутствует обмен Е, возникают общие электронные пары.
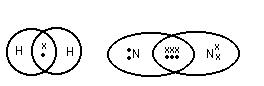 |
Каждая пара находится на своей орбитали. Разновидностями является ![]() и
и ![]() связь.
связь.
Ковалентная полярная связь: ковалентные связи в случае их полярности имеют определённые направленности и определённую форму молекулы.
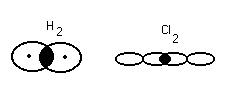 Пример: 1. неполярная ковалентная связь
Пример: 1. неполярная ковалентная связь
2. ![]() - молекула воды 2Р – электрона и 2 S – элемента
- молекула воды 2Р – электрона и 2 S – элемента
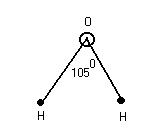 |  | ||
Этот L определяет отчасти сложные свойства воды
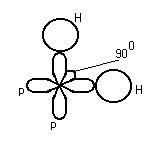
3. ![]()
Гибридизация электронных облаков ![]()
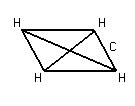 |
4. ![]()
![]()
![]() (Образуется линейная структура)
(Образуется линейная структура)
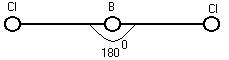 |
1.7 Сигма и П – связь
На примере этилена
С2Н4
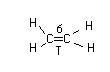 |
![]() - связь, которая действует по кратчайшему расстоянию и связывает центры взаимодействия атомов.
- связь, которая действует по кратчайшему расстоянию и связывает центры взаимодействия атомов.
![]()
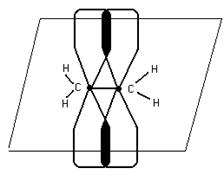 П – связь расположена в плоскости,
П – связь расположена в плоскости,
перпендикулярной плоскости б
б- более прочная, в отличии от П
2. Получение сверхтяжелых изотопов легких элементов
Всем хорошо известны изотопы легких элементов, отличающиеся по составу ядра на один-два нейтрона: углерод-12 и -14, кислород-16 и -18, фосфор-31 и -32. Но что может произойти, если ввести 14 или даже 16 дополнительных нейтронов в ядро легкого атома?
