Соединения, изолируемые перегонкой с водяным паром кетоны - ацетон
Ацетон

Синонимы: Диметилкетон, 2-пропанон
1.1 Свойства
Ацетон – это бесцветная горючая жидкость с характерным запахом. Смешивается со спиртом, эфиром и водой в любых соотношениях. Не образует азеотропной смеси с водой. Из водных растворов ацетон высаливается хлоридом натрия, хлоридом кальция, карбонатом калия (жидкость разделяется на два слоя). Ацетон хорошо растворяет соли многих неорганических кислот и ряд органических соединений. Ацетон получают при сухой перегонке дерева, каменного угля, а также путем синтеза. 3-й класс опасности, хорошо смешивается с водой и спиртом, смесь ацетона и воздуха взрывоопасна.
Таблица 1.1 Свойства ацетона
|
Молекулярный вес |
58,08 |
|
Температура плавления |
-95,35 0С |
|
Температура кипения |
56,24 0С |
|
Температура вспышки |
-18 °С |
|
Температура самовоспламенения |
500 °С |
|
Температурные пределы воспламенения паров в воздухе |
нижний – -20 °С верхний – 6 °С |
|
Концентрационные пределы воспламенения паров в воздухе |
нижний – 2,2% (по объему) верхний – 13% (по объему) |
|
Минимальная энергия зажигания паров в воздухе |
0,6 мДж |
|
Плотность |
0,79 г./см3 |
|
Дипольный момент при 2 Дебай |
2,72 |
|
Вязкость, сантипуазы при 15 С |
-0,3371 |
|
Поверхностное натяжениепри 20 С |
: 23,32 дины на сантиметр |
|
Показатель преломления |
1,358825 |
Ацетон обладает всеми химическими св-вами, характерными для алифатических кетонов. Он образует кристаллические соединения с гидросульфитами щелочных металлов, например с гидросульфитом натрия – (CH3)2C(OH) SO3Na.
Только сильные окислители, например щелочной раствор калия перманганата и хромовая кислота, окисляют ацетон до уксусной и муравьиной кислот и далее – до СО2 и воды.
Каталитически ацетон восстанавливается до изопропанола, амальгамамы Mg или Zn, а также цинком с уксусной кислотой – до пинакона.
Атомы водорода в ацетоне легко замещаются при галогенировании, нитрозировании и т.п. Действием хлора и щелочи (напр. натрия гидроксидом) ацетон превращается в хлороформ, который взаимодействует с ацетоном с образованием хлорэтона, применяемого как антисептик.
Ацетон окисляет вторичные спирты в присут. алкоголятов Аl до кетонов.
Ацетон вступает в альдольную конденсацию с образованием диацетонового спирта, а также в кротоновую конденсацию с образованием окиси мезитила (СН3)2С=СНСОСН3, форона (СН3)2С=-СНСОСН=С(СН3)2 и мезитиленацетона.
В присутствии сильной минеральной кислоты (например серная кислота) ацетон алкилирует фенол с образованием дифенилолпропана (бисфенола ацетона) (НОС6Н4)2С(СН3)2, присоединяет цианид- ион с образованием ацетонциангидрина (CH3)2C(OH) CN.
При пиролизе (700 °С) ацетона образуются кетен СН2=С=О и метан.
1.2 Применение
В промышленности ацетон получают преимущественно так называемым кумольным способом одновременно с фенолом из бензола и пропилена через изопропилбензол (кумол) по схеме:
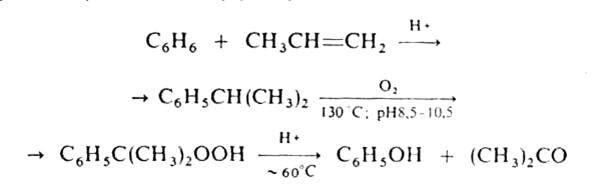
В ряде других промышленных способов синтеза ацетон исходят из изопропанола:
1. Окисление в паровой фазе (катализатор – металлический Cu, Ag, Ni или Pt):
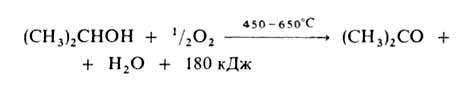
Высокий выход ацетона (≈90%) достигается при использовании Ag, осажденного на пемзе, или серебряной сетке.
2. Автокаталитическое окисление в жидкой фазе при 90–140 °С и 0,2–0,3 МПа:
![]()
Выход ацетона 95% от теоретического, Н2О2 87%.
3. Дегидрирование в паровой фазе в присутствии ZnO, осажденной на пемзе:
![]()
Степень превращения изопропанола в ацетон при 225 °С составляет 84% при 380 °С – 98%, при 525 °С – 100%. Выход ацетона около 90%.
Новый промышленный способ получения ацетона – прямое окисление пропилена в жидкой фазе в присутствии PdCl2 в среде водного раствора солей Pd, Fe или Cu при 50–120 °С и 5–10 МПа:
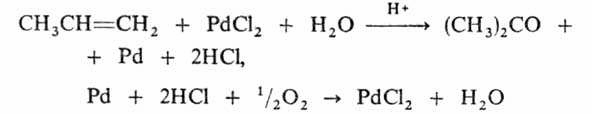
Выход ацетона 90%. Некоторое значение сохранил способ получения ацетона брожением крахмала под влиянием бактерий Bacyllus acetobutylicus, превращающих крахмал в ацетон и бутанол (так называемое ацетоновое брожение). Известны и др. способы получения:
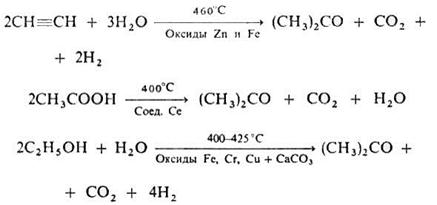
Технический ацетон широко применяется в лакокрасочной промышленности в качестве растворителя нитролаков, нитроэмалей (при выработке авиационных, автомобильных, кабельных, кожевенных и других лаков), при получении ацетилцеллюлозы и нитроцеллюлозы, в производстве некоторых сортов искусственного шёлка, при изготовлении органического небьющегося стекла, в производстве киноплёнок, бездымного пороха, целлулоида, акрихина и других.
Способность ацетона растворять ацетилен используется в широких масштабах при наполнении стальных баллонов, в которых хранится ацетилен, применяемый для сварки металлов. Ацетилен поглощается пористым материалом, пропитанным ацетоном; при давлении 15 атм. 1 объём он растворяет 375 объёмов ацетилена.
Применение ацетона для извлечения воска из смазочных масел приобретает всё большее значение. Ацетон служит сырьём для производства многих химических продуктов: синтетического каучука, индиго, ионона (духи), сульфонала (снотворное средство). Соединения ацетона с солями сернистой и гидросернистой кислот применяют при крашении и печатании тканей.
Технический ацетон находит применение в производстве искусственной кожи, для обеззараживания шерсти и меха, для извлечения эфирных масел. Чистый ацетон применяется в пищевой промышленности при экстрагировании пищевых продуктов, витаминов, жиров; для экстрагирования некоторых лекарств и приготовления фармацевтических препаратов, требующих химически чистого растворителя с низкой температурой кипения.
