Соответствие лекарственного вещества показателям мутности. Условия титрования
ROOC—СН2—COOR+C4H9ONO -* ROOC—С—COOR * ROOC—СН—COOR
1) I
NOH NH3
(СН3СО)4 О Na; RBr; НгО
v ROOC—СН—COOR > R—СН—СООН
I I
NHCOCH3 NHa
Из приведенных схем синтеза различных аминокислот следует, что этот метод пригоден для синтеза всех известных аминокислот. Наряду с галоидалкилами стали широко использовать акролеин, эфиры акриловой кислоты и акрилонитрил, что позволило одновременно вводить радикалы и новые функциональные группы.
(COOR)2 II
СН2=СН~СОН COOR НСО—СН2—СН2—С—NHCOCH3
I 7
CH2=CH-COOR + HC-NHCOCHj - ROOC—СН2-СН2-С—NHCOCH3
I \ il
COOR \ (COOR)2
CHa=CH—CN NC-CH2—CH2—C—NHCOCH3
II
(COOR)2
Использование реакции Манниха еще более расширило рамки применения аминомалонового эфира. Вторичные амины и соединения с подвижным водородом у С-атома конденсируют с формальдегидом. Образующиеся третичные амины также легко реагируют с аминомалоновым и циануксусным эфирами, как и галоидалкилы (см. например синтез триптофана). Можно проводить конденсацию между диметиламином, формальдегидом и ацетиламиномалоновым эфиром. В полученном соединении диметиламин легко замещается на другие группы, так, например, при реакции с цианистым натрием с последующим омылением получают аспарагиновую кислоту.
COOR COOR
\ I
(СН3)2 NH+HCOH+HC—NHCOCH3 -* (СН3)2 NCH2—С—NHCOCH3
/ I
COOR COOR
NH2
NaCN H20 I
„ > (CH3)2 NH+HOOC—СН2—СН—соон
Аналогично используют циануксусный и нитромалоновый эфиры, но их применяют менее широко.
I. ROOC—СН2—CN ROOC—С—CN -* ROOC—СН—CN-+
II I
NOH NHNa; RBr, НЮ ROOC—СН—CN R—СН—СООН
I I
NHA с NH2
R
I\a, RBr j H2, H20
] I ROOC — CH—COOR -— ? ROOC—C—COOR ? R—CH—COOHL
I / I
NO™ NO- NH2
В 1940 г. В. В. Феофилакгов предложил оригинальный путь синтеза аминокислот из ацетоуксусного эфира, основанный на его способности реагировать с диазосоединениями. Алкил- или арилацетоуксусный эфир обрабатывают арилдиазотатом и тотчас же подвергают кислотному расщеплению. Образующееся азопроизводное изомеризуется в гидразон кетокислоты, который восстанавливают до аминокислоты и анилина.
кон
СН3СОСН (R) COOCaHa+CeHsNaOK-CHgCOC (R) СООС2Н5
N=NC6H5
н2*СН3СООН + C2HS0H+RC—СООН ? RCH—COOH+NH2C6H5
il 1
N—NHC6H5 NH2
Реакция была проверена на большем числе примеров. Особенно успешно она проходит с соединениями ароматического ряда.
Ароматические аминокислоты можно получать с достаточно хорошими выходами, пользуясь вариантами реакции Перкина — кротоновой конденсацией. Самым распространенным из них является так называемый азлактоновый метод, разработанный Эрленмейером.
При конденсации ароматических альдегидов с ацилглицином (чаще всего пользуются гиппуровой кислотой) в присутствии уксусного ангидрида и безводного ацетата натрия образуется 2-фенил-4-арилиден-5-ок-сазолон (азлактон), который при восстановлении и гидролизе превращается в аминокислоту.
СбН5СОН+СН2—СООН+ (СН3СО)2 O+CHgCOONa - С6Н5СН-С—СО
I 1 I
NHCOC6H5 N О —
V I с
I
СбН5
Нг; Н20
> у С6Н5СН2—СН—СООН
I
NH
Реакция основана на подвижности метиленовой группы. В настоящее время доказано, что на первой стадии реакции происходит циклизация ацилглицина под действием уксусного ангидрида в 2-арилоксазолон,
СН2—СООН СН2—СО
I I I
NHCOC6H5+(CH3CO)2 О - N О
Ч/ С—СбН5
обладающий активной метиленовой группой, которая взаимодействует •с альдегидами.
У0 CHsCOONd
С6Н3-С + СН2—СО - С6Н5СН=С—СО
\ I ! 11
Н N О NO
\ / V/ U
С—СбНб С—СбНв
Картером и рядом других авторов было показано, что реакция может идти и с алифатическими альдегидами, но выходы аминокислот в этих случаях незначительны. Тот же принцип использования подвижности метиленовой группы лежит в основе синтеза ароматических аминокислот путем конденсации альдегидов с дикетопиперазинами, гидантоинами и другими соединениями, имеющими подвижный атом водорода. Ниже представлена схема подобных реакций.
CO~NH
>СН2 XNH—СО
СО—NH
1. АгСНО+СЧ2
ArCH2CHCCCrL I / ч
Вопрос 61
Количественное определение висмута нитрата основного. Дать обоснование оптимальных условий титрования. В чем отличие методики определения от других препаратов (кальция, магния)?
Соединения висмута, вводимые внутрь путем инъекций, очень токсичны, так как образуют прочные химические связи с тиоловыми группами биогенных соединений, например ферментов: Bi(SR)3. При попадании в пищеварительный тракт соединения практически безвредны даже в больших количествах. Это объясняется малой растворимостью основных солей висмута, например BiOHS04. Препараты висмута применяются внутрь при желудочно-кишечных заболеваниях, связанных с накоплением соединений серы в кишечнике, которые, взаимодействуя с солями висмута, образуют не растворимый в кислотах и щелочах висмута сульфид Bi2S3. Из неорганических ЛС висмута фармакопейным препаратом является висмута нитрат основной.
Количественное определение.
Поскольку состав образующихся при гидролизе основных солей висмута непостоянен, применение гравиметрического и объемного методов для количественного определения дает, как правило, недостаточно точные результаты.
В ГФ для количественного определения висмута нитрата основного принят комплексонометрический метод (трилонометрический, хелатометрический), где в качестве титранта служит раствор трилона Б — динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА):
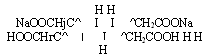
В качестве индикатора можно использовать пирокатехиновый фиолетовый (катехиновый фиолетовый, пирокатехинсульфофталеин) или ксиленоловый оранжевый (трифенилметановые красители). Титрование проводят в присутствии азотной кислоты. В процессе титрования титрант Ка2Н2ЭДТА связывает ионы висмута, образовавшиеся при растворении препарата в азотной кислоте, в комплексное соединение:
Ка2Н2ЭДТА + Bi(N03)3 — Ка[В1ЭДТА] + 2HN03 + NaN03
Вблизи точки эквивалентности окраска раствора изменяется от синей до желтой (пирокатехиновый фиолетовый) или от красной до желтой (ксиленовый оранжевый).
Выделяющаяся азотная кислота не мешает титрованию, так как соли висмута количественно взаимодействуют с Na2H23flTA при рН 2—4. Комплексное соединение висмута (Ш) с металлохромными индикаторами имеет меньшую константу устойчивости, чем комплекс Bi (III) с ЭДТА. Поэтому в эквивалентной точке, когда комплекс с индикатором полностью разрушен, а висмут (Ш) связан с гексадентатным лигандом (ЭДТА), выделяется свободный индикатор и окраска раствора меняется.
Вопрос 63
Привести примеры окислительно-восстановительных методов, которые можно применить для количественного определения йодидов в присутствии кальция хлорида. Написать схемы химических реакций.
К ЛС р-элементов VII группы ПСЭ относятся препараты галогенов и препараты галогенидов. К препаратам галогенов относят препараты йода.
Количественное определение. Для количественного определения йода точную его навеску растворяют в растворе йодида калия и титруют тиосульфатом натрия, применяя в качестве индикатора крахмал (до исчезновения синей окраски):
