Структура молекулы воды и ее ионов
Вода – наиболее распространенное химическое соединение. Разнообразие свойств, которые может проявлять вода, скрыты в различиях структуры молекулы воды. Полученная нами информация позволяет приступить к раскрытию и анализу структурных особенностей молекулы воды.
Связи между атомами в молекуле формируют поверхностные электроны, которые мы называем еще и валентными. Валентные электроны атомов, образующих молекулу, могут вступать в связь друг с другом или с протонами ядер, если ячейка ядра, где расположен протон, оказывается свободной. Это свойственно атому водорода.
Часть модели молекулы воды изображаются так, что угол между атомами водорода составляет 105![]() . Если считать, что он соответствует реальности, то с учетом модели ядра атома кислорода, модель молекулы воды будет такой, как показано на рис. 1. Эта модель дает основание считать, что электростатические силы отталкивания, действующие между первым (e1, P1) и вторым (e2, P2) атомами водорода, формируют угол 105
. Если считать, что он соответствует реальности, то с учетом модели ядра атома кислорода, модель молекулы воды будет такой, как показано на рис. 1. Эта модель дает основание считать, что электростатические силы отталкивания, действующие между первым (e1, P1) и вторым (e2, P2) атомами водорода, формируют угол 105![]() . Он образуется, видимо, у кластеров молекул воды, когда она замерзает и превращается в лёд.
. Он образуется, видимо, у кластеров молекул воды, когда она замерзает и превращается в лёд.
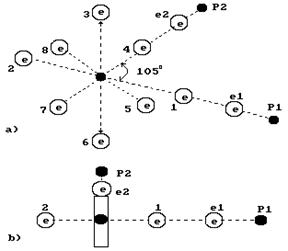
Рис. 1. Структура молекулы воды с углом 105![]() между атомами водорода
между атомами водорода
На рис. 2 показана структура молекулы воды, следующая из структур ядер атомов кислорода и водорода. Два электрона 1 и 2 атома кислорода расположены на оси атома, а шесть остальных – по кругу, перпендикулярному оси.
Можно предположить, что суммарное электростатическое поле шести электронов, расположенных по кругу (назовем их кольцевыми электронами), удаляет первый и второй осевые электроны на большее расстояние от ядра атома, чем то расстояние от ядра атома, на котором распложены кольцевые электроны.
Поэтому осевые электроны атома кислорода являются его главными валентными электронами. Именно к этим электронам и присоединяются электроны атомов водорода и образуется молекула воды (рис. 2).
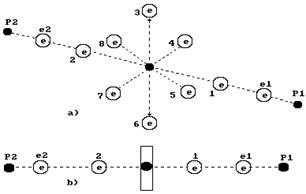
Рис. 2. Схема первой (заряженной) модели молекулы воды:
a) пространственная схема;
b) линейная схема 1,2,3,4,5,6,7,8 - номера электронов атома кислорода;
![]() - ядра атомов водорода (протоны);
- ядра атомов водорода (протоны);
![]() и
и ![]() - номера электронов атомов водорода
- номера электронов атомов водорода
Символами ![]() и
и ![]() обозначены электроны атомов водорода и символами
обозначены электроны атомов водорода и символами ![]() и
и ![]() - протоны атомов водорода. Номера электронам мы присваиваем в соответствии с последовательностью увеличения их потенциалов ионизации. Первым номером мы обозначили электрон атома кислорода, имеющий наименьший потенциал ионизации
- протоны атомов водорода. Номера электронам мы присваиваем в соответствии с последовательностью увеличения их потенциалов ионизации. Первым номером мы обозначили электрон атома кислорода, имеющий наименьший потенциал ионизации ![]() . Номером 2 мы обозначили второй электрон атома кислорода, имеющий потенциал ионизации
. Номером 2 мы обозначили второй электрон атома кислорода, имеющий потенциал ионизации ![]() .
.
Обратим внимание на то, что осевые протоны ядра атома кислорода отделены друг от друга кольцевыми и осевыми нейтронами.
Поэтому при удалении из атома кислорода одного осевого электрона освободившиеся силовые линии магнитного поля осевого протона перераспределяются в цепочке протон - нейтрон-нейтрон - протон так, что напряженность магнитного поля свободного осевого протона ослабнет, а напряженность магнитного поля второго осевого протона, взаимодействующего со вторым электроном, усилится, и энергия его ионизации увеличится до ![]() .
.
Описанное явление присуще, по-видимому, всем ядрам. Этот процесс назван процессом насыщения. Иначе нарушается равенство между электростатическими силами, сближающими электроны с протонами, и магнитными силами, ограничивающими это сближение в случаях, когда часть электронов покидает атом.
Структура атома водорода показывает, что если этот атом соединится с первым осевым электроном атома кислорода своим единственным электроном, то протон окажется на поверхности молекулы и образует зону с положительным зарядом, который будет генерироваться протоном атома водорода.
Аналогичную зону сформирует и протон второго атома водорода, который соединяется со вторым осевым электроном атома кислорода (рис. 2). Отрицательно заряженную зону сформируют электроны атома кислорода, расположенные по кольцу вокруг оси атома кислорода.
Поскольку при охлаждении электроны излучают фотоны и приближаются к ядру атома, то шесть кольцевых электронов атома кислорода в молекуле воды (рис. 2), приближаясь к ядру атома, своим статическим полем удаляют осевые электроны от ядра. В этом случае расстояние между атомами водорода, расположенными на оси молекулы воды, увеличивается.
За счет этого увеличивается длина связи с соседними молекулами воды при её замерзании. С учетом этого мы отдаем предпочтение модели молекулы воды, показанной на рис. 2, и в дальнейшем будем использовать только эту модель.
Анализ изменения свойств воды с использованием модели, показанной на рис. 1, оставляем другим исследователям.
Обратим внимание на то, что кластеры воды формируются, прежде всего, протон - протонными связями, когда две её молекулы соединяются соосно.
Если учесть, что размер протона на три порядка меньше размера электрона, то протон – протонная связь легче разрушается при механическом воздействии на такой кластер. Второй вариант образования кластера – соединение осевого протона с кольцевым электроном. Это – протон – электронная связь. Её прочность тоже меньше прочности электрон - электронной связи, которую имеют молекулы азота и кислорода. Эти факты и проясняют текучесть воды.
Молекулы воды формируют кластеры различных форм. При определённых условиях и определённой температуре (в зимних облаках) шесть молекул воды присоединяются своими протонами атомов водорода к кольцевым электронам другой молекулы воды или атома кислорода. В результате образуется шести лучевая структура, которая с увеличением размера и усложнением формирует ажурную шести лучевую структуру – снежинку.
Этот естественный процесс реализуется при строго определённых энергиях связи валентных электронов, которые зависят от энергий поглощаемых и излучаемых фотонов.
Известны экспериментальные факты, когда вода, облучаемая мелодией спокойной классической музыки, формирует симметричные шести лучевые структуры. Такие же структуры формируются при облучении воды спокойным молитвенным голосом, при котором тело молящегося излучает такие фотоны, которые необходимы для формирования связей симметричных структур. Не случайно поэтому, что такая вода, как это уже доказано, обладает лечебными свойствами.
