Таблица Менделеева
Дм. Ив. стал готовиться к включению в «пасьянс» карточек тяжёлых элементов из 3-ей кучки.
Размещение тяжёлых металлов. Всего в 3-ей кучки было с самого начала 17 карточек: к ним присоединилась последняя карточка Be из 2-ой кучки, оставшаяся не включенная в « пасьянс». Таким образом, здесь оказалось 18 карточек.
Всего на этой стадии составления таблицы элементов в «пасьянс» было включено 12 карточек из 3-ей кучки. Остальные 9 элементов не присутствовали в нижней таблице.
Поскольку после размещения карточек тяжёлых металлов из 3-ей кучки следовало к размещению карточек сомнительных элементов из 4-ой кучки, то было вполне естественно, что к этим последним Дм. Ив. присоединил карточку Ir, оставшуюся из 3-ей кучки.
Для полной ликвидации второго промежуточного столбца осталось снять Ir=72? В итоге карточка Ir вновь вернулась в 4-ую кучку. В результате всех этих действий не включёнными в систему оказались 4 элемента: Ir, Er, Th, Yt.
Продолжая размещение сомнительных элементов, Дм. Ив. выносит на верхний край системы Yt, Th, Er, и, наконец Ir фиксирует этот заключительный момент составления полной таблицы элементов. Дм. Ив. завершил работу над системой. Так завершился 4-ый(решающий) этап открытия периодического закона.
Теперь, когда периодический закон был открыт, и была составлена периодическая система элементов в первом её варианте, оставалось сделать ещё один шаг. Речь шла о подготовке полученного результата к его публикации.
Так прошёл один из величайших дней в истории науки, день открытия периодического закона и создания периодической системы химических элементов.
Отдав в типографию для набора рукопись «Опыты системы элементов», Дм. Ив., естественно, не мог уехать из Петербурга на сыроварни до тех пор, пока не пришла корректура, которую он просил прислать поскорее.
Для набора требовалось некоторое время, и это время Менделеев использовал для того, чтобы обобщить и обратить сделанное им открытие в виде стать, изложив в ней, то что было заключено в «Опыте системы элементов». Дм. Ив. решил опубликовать статью в только что начавшем выходить с 1869 г. «Журнале Русского химического общества».
В связи с опубликованием статьи о периодическом законе в «Журнале Русского химического общества» Менделееву нужно было доложить её содержание на заседании Русского химического общества, которое собиралось по первым четвергам каждого месяца. Ближайшее после 17 февраля 1869 г. заседание приходилось, таким образом, на 6 марта 1869 г.
При подготовке статьи, которая должна была являться докладом для чтения на заседании Русского химического общества, Дм. Ив. обратил особое внимание на различные таблицы элементов, в которых может быть выражена периодичность свойств элементов. Возможность таких форм была выявлена Менделеевым до составления «Опыта системы элементов». Не случайно он назвал свою первую таблицу именно опытом системы, а не системой элементов, подчёркивая этим её предварительной, пробной, не окончательный характер.
Лишь в октябре 1869 г., спустя семь с половиной месяцев со дня открытия периодического закона, Дм. Ив. отказывается от признака прочности соединения и переходит к признаку их предельности при обоснования распределения элементов по их группам в периодической системе элементов.
Далее Дм. Ив. указывает на то, что было сделано много попыток «открыть законность в тех отношениях, какие замечаются в рядах элементов, принадлежащих к одной группе».
Приёмы определения величины атомных весов Дм. Ив. считает незыблемыми и несомненными, так что не возникает сомнений в величине истинного атомного веса для большинства элементов, особенно для тех, теплоёмкость которых в свободном состоянии уже определена.
Тем не менее для подавляющего большинства элементов атомные веса были установлены в общем правильно, что позволило Дм. Ив. расположить эти элементы в последовательные ряды по величине атомных весов и открыть периодический закон.
Таким образом, у Менделеева была твёрдая уверенность в фундаментальности свойства атомного веса и в истинности атомных весов большинства элементов.
Работая над своей 1-ой статьёй о периодическом законе Дм. Ив. составил несколько вариантов периодической системы с целью рассмотреть открытую им закономерность с различных сторон и в различных её проявлениях.
Появляется несколько вариантов системы элементов:
1. «Опыт системы элементов»
2. Второй вариант периодической системы элементов.
3. Третий вариант по сути дела мало чем отличается от предыдущего; только здесь группы расположены не горизонтально, а вертикально столбцами.
4. Четвёртый по счёту её вариант получался из «Опыта системы элементов» путём «отсечения» H и семи «сомнительных элементов» и переноса оставшихся двух нижних строк элементов на самый верх таблицы. Такой вариант системы элементов можно назвать «длинной» таблицей с растянутыми малыми периодами. Итак, всё содержание статьи «соотношение свойств с атомным весом элементов» неоспоримо свидетельствует о том, что в этой статье Дм. Ив. отразил, обобщил и подытожил тот путь, каким он шёл в день 17 февраля 1869 г. при создании периодической системы элементов. Первая статья Менделеева была посвящена только что открытому периодическому закону. Эта статья была написана в течение 11 дней с 18 по 28 февраля, и не позднее 1 марта 1869 г. была передана редактору «Русского химического общества». А сейчас рассмотри по одному элементу из каждой группы.
1. 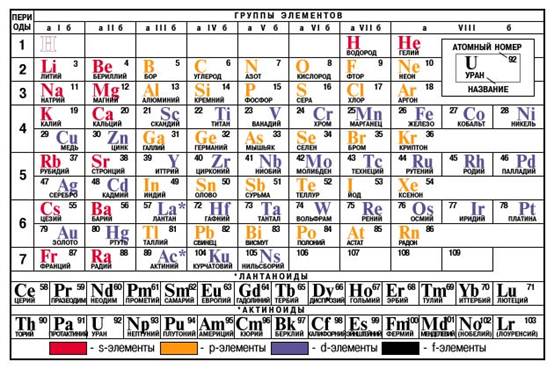 Литий Li - химический элемент I группы периодической системы Менделеева; атомный номер 3, атомная масса 6,94; относится к щелочным металлам.
Литий Li - химический элемент I группы периодической системы Менделеева; атомный номер 3, атомная масса 6,94; относится к щелочным металлам.
Физические свойства. Li самый лёгкий (p=0,53 г/см³) из металлов, почти вдвое легче воды. Он серебристо-белого цвета, с ярким металлическим блеском.( Tплав = 180,5°С, Tкип=1317°С). Литий мягок, легко режется ножом. На воздухе быстро тускнеет, соединяясь с кислородом. Степень окисления = 2.
Химические свойства. Литий взаимодействует с водой, образуя щёлочь LiOH, при этом он не воспламеняется. Зато с азотом , углеродом, водородом литий реагирует легче других металлов.
Некоторые соли лития (карбонат, фторид и др.) в отличие от аналогичных солей его соседей плохо растворяются в воде.
2. Бериллий Be – химический элемент II группы периодической системы Менделеева; атомный номер 4, атомная масса 9,012.
Долгое время многие химики считали, что Be – трёхвалентный металл с атомной массой 13,8. Для такого металла не находилось места в периодической системе и тогда, несмотря на очевидное сходство Be с Al, Дм. Ив. поместил этот элемент во II группу, изменив его атомную массу на 9. Вскоре шведские учёные нашли, что атомная масса Be = 9,01 и это соответствовало предположению Менделеева.
Физические свойства. Чистый Be – светло-серый, лёгкий(p=1,85 г/см³), твёрдый металл.
