Теория МОХ
Нормировка МО аллила в МОХ: ci12 + ci2 2 + ci3 2 =1.
Для хюккелевских МО вычисляется нормировочный множитель МО.
.из ненормированных коэффициентов (Ai1, Ai2, Ai3): Ni=(Ai12+Ai22+Ai32)-1/2.
Классификация-систем. Индексы электронной структуры.
Общие свойства электронного распределения в -системе хюккелевского углеводорода
В углеводородах, образованных только из sp2-гибридных атомов C, все валентные углы между -связями равны 120o. Такие структуры не являются напряжёнными. Они называются альтернантными (по-русски буквально «чередующимися»). Монослой графита идеальный прообраз альтернантной -системы.
Признак альтернантности имеет топологическое происхождение. Он состоит в том, что любые два соседние атома C в -системе можно маркировать двумя разными символами (например, .CoC+Co .). По завершении чередующейся маркировки все атомы разделяются на два сорта. В составе любой двухцентровой связи CoC+ оказываются атомы только разных сортов.
Это свойство не соблюдается у систем неальтернантных.
Числа заполнения МО (заселённости МО) равны gi=0,1,2.
Парциальные заселённости АО p в пределах МО i, равны
nip=cip2gi .
Заселённость отдельной АО p получаются суммированием по всем МО. (Индекс МО в качестве дискретной переменной при суммировании исчезает):
np=i gicip2.
Эта заселённость есть не что иное, как -электронный заряд, отрицательный по знаку, сформированный на атоме Cp.
У альтернантных углеводородов по методу МОХ все атомные -электронные заряды одинаковы и равны 1.
(На каждом атоме суммарная электронная заселённость осталась неизменной по сравнению с исходным валентным sp2-гибридным состоянием атома C превнёс в общую -систему).
У неальтернантых углеводородов атомные -электронные заряды неодинаковы.
Атомные заряды в методе МОХ у хюккелевских углеводородов образуются как разности Qp=1- np.
Парциальный порядок -связи CpCq определяется для двух пространственно соседних АО в пределах одной из занятых МО i и равен
ppq=gi cipciq,
Порядок -связи CpCq получаются суммированием парциальных порядков по всем МО. Он определяется для двух соседних АО и равен (Индекс МО в качестве дискретной переменной при суммировании исчезает):
ppq=i gicipciq,
В качестве эталонной системы, у которой максимально реализовано -связывание, принимают бирадикал триметиленметил ·C(CH2)3.
У третичного атома С сумма порядков трёх одинаковых -связей максимальна и равна 31/2. Поэтому в качестве индекса свободной валентности атома Cp в системе сопряжения принимают разность между этим значением и суммой порядков связей, образуемых данным атомом: Fp=31/2 -q ppq
Результаты вычислений целесообразно представить в единой таблице.
|
- МО |
Корни |
Энергия |
gi |
A11 |
A12 |
A13 |
- МО | ||||
|
(-1)1+1 (X2-1) |
(-1)1+2X |
(-1) 1+3(1) | |||||||||
|
X |
E |
X2-1 |
-X |
1 |
Ni |
C 1 |
C 2 |
C 3 | |||
|
1 |
+(21/2) |
- 21/2× |
|
+1 |
- 21/2 |
+1 |
1/2 |
+1/2 |
-2-1/2 |
+1/2 |
Разр. |
|
|
|
|
|
-1 |
0 |
+1 |
1/21/2 |
-1/21/2 |
0 |
+1/21/2 |
Несв. |
|
3 |
- (21/2) |
+21/2× |
|
+1 |
+21/2 |
+1 |
1/2 |
+1/2 |
+2-1/2 |
+1/2 |
Связ. |
Профильные графические диаграммы МО показывают распределение узлов и пучностей в цепочке -связей между атомами. Их происхождение обсуждалось на примере иона H2+.
Здесь же на энергетической диаграмме удобно представить максимальное количество информации.
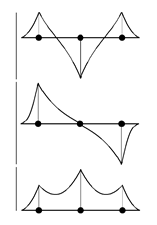 j3*
j3*
E3*=; g3=0
j2(n)
E2n=; g2=1
j1(bond)
E1=; g1=2
Электронная конфигурация: (j1(bond))2, (j2(n) )1 , (j3*)0
Атомные характеристики
Характеристики АО, атомов, связей
Матрица связей является трафаретом для описания электронного распределения.
