Теория растворов
Используя закон распределения, можно рассчитать процесс экстрагирования. Пусть вещество подлежащее извлечению находится в растворе объёмом V в количестве, и пусть для извлечения его из раствора используют подходящий растворитель объёмом. Если к раствору объёмом V добавить растворитель ![]() и смесь хорошо перемешать до наступления равновесия, то часть растворённого вещества из раствора перейдёт в растворитель. Обозначим количество извлечённого вещества оставшегося в растворе, тогда его концентрация в этом растворе
и смесь хорошо перемешать до наступления равновесия, то часть растворённого вещества из раствора перейдёт в растворитель. Обозначим количество извлечённого вещества оставшегося в растворе, тогда его концентрация в этом растворе ![]() . Его концентрация в
. Его концентрация в ![]()
![]() . Коэффициент распределения
. Коэффициент распределения ![]() .
. ![]() Количество извлечённого вещества
Количество извлечённого вещества ![]() . Если отделить раствор с помощью делительной воронки, к оставшемуся раствору в котором извлечённого вещества добавить свежеприготовленного растворителя
. Если отделить раствор с помощью делительной воронки, к оставшемуся раствору в котором извлечённого вещества добавить свежеприготовленного растворителя ![]() , то обозначим через количество растворённого вещества в растворе после второго экстрагирования. Будем иметь
, то обозначим через количество растворённого вещества в растворе после второго экстрагирования. Будем иметь ![]() ;
;![]() ;
; ![]() . Если экстрагировать n- раз
. Если экстрагировать n- раз ![]() , где
, где ![]() - количество извлекаемого вещества которое осталось в растворе V n-го после экстрагирования. Количество извлечённого вещества при этом определяется
- количество извлекаемого вещества которое осталось в растворе V n-го после экстрагирования. Количество извлечённого вещества при этом определяется ![]() . если экстрагировать 1 раз, но V
. если экстрагировать 1 раз, но V ![]() , то количество экстрагированного вещества определяется
, то количество экстрагированного вещества определяется ![]() . Эффективнее экстрагировать
. Эффективнее экстрагировать ![]() раз обьёмом V чем один раз -
раз обьёмом V чем один раз - ![]() .
.
Совершенные растворы
Образуются в том случае, если компоненты весьма близки по своим физикохим. свойствам (растворы оптических изомеров, расплавы близких по свойствам природных веществ (Fe и Ni). Совершенные растворы, образованные без изменения V и без теплового эффекта. По этой причине V и Н бинарного совершенного раствора выражается уравнением: ![]()
![]() , здесь и - молярный V 1-ого и 2-ого компонентов, а и - молярные энтальпии этих компонентов в чистом виде
, здесь и - молярный V 1-ого и 2-ого компонентов, а и - молярные энтальпии этих компонентов в чистом виде ![]() ;
; ![]() . Парциальный молярный V равен просто молярному V
. Парциальный молярный V равен просто молярному V ![]() ;
; ![]() т.к.
т.к. ![]() то
то ![]() , это означает, что тенденция к образованию такого раствора определяется увеличением энтропии
, это означает, что тенденция к образованию такого раствора определяется увеличением энтропии ![]() . В отличии от величин Н и V величины G и S преобр. совершенного раствора не аддитивны. Энтропия S определяется отношением:
. В отличии от величин Н и V величины G и S преобр. совершенного раствора не аддитивны. Энтропия S определяется отношением: ![]() ;
; ![]() - энтропии чистых компонентов относящихся к 1 молю, а – изменение энтропии при смешении компонентов. Изменение энтропии при смешении 1 и 2 компонента определяется:
- энтропии чистых компонентов относящихся к 1 молю, а – изменение энтропии при смешении компонентов. Изменение энтропии при смешении 1 и 2 компонента определяется: ![]() . Изменение энтропии при образовании 1 моля раствора
. Изменение энтропии при образовании 1 моля раствора ![]() . Изменение G при образовании 1 моля раствора
. Изменение G при образовании 1 моля раствора ![]() . Т к
. Т к ![]()
![]() и
и ![]() , то
, то ![]() , то есть совершенный раствор образуется самопроизвольно при любых концентрациях, при любых соотношениях компонентов. Для любого компонента совершенного раствора хим. потенциал определяется
, то есть совершенный раствор образуется самопроизвольно при любых концентрациях, при любых соотношениях компонентов. Для любого компонента совершенного раствора хим. потенциал определяется ![]() : . Для обоих компонентов бинарного совершенного раствора при любых его концентрациях соблюдается закон Рауля
: . Для обоих компонентов бинарного совершенного раствора при любых его концентрациях соблюдается закон Рауля ![]() и
и ![]() . Давление пара над раствором
. Давление пара над раствором ![]() ;
; ![]() . Как парциальное давление каждого компонента так и общее давление пара над раствором является линейной функцией состава.
. Как парциальное давление каждого компонента так и общее давление пара над раствором является линейной функцией состава.
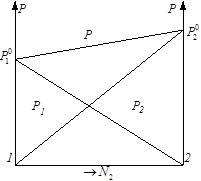
Чтобы построить диаграмму давление-состав для совершенного раствора, достаточно знать лишь давление насыщенного пара каждого из компонентов в чистом состоянии при данной температуре. В случае совершенного раствора легко определить состав пара над раствором. В общем случае составы равновесных жидкости и пара не совпадают. Обозначим и – молярные доли 1 и 2 компонента в насыщенном паре над раствором. По закону Рауля ![]() и
и ![]() . По закону Дальтона
. По закону Дальтона ![]() и
и ![]() , где –P общее давление пара над раствором
, где –P общее давление пара над раствором ![]() а
а ![]() . и
. и ![]()
![]() Соответственно
Соответственно ![]() по этим формулам можно подсчитать молярные доли компонентов в равновесной паре над совершенным раствором, если известен состав раствора. Сопоставив закон Рауля и Дальтона можно написать
по этим формулам можно подсчитать молярные доли компонентов в равновесной паре над совершенным раствором, если известен состав раствора. Сопоставив закон Рауля и Дальтона можно написать ![]() . Составы пара и жидкости будут одинаковы только тогда, когда будут равны давлению насыщенного пара компонентов в чистом состоянии, что бывает очень редко. Если
. Составы пара и жидкости будут одинаковы только тогда, когда будут равны давлению насыщенного пара компонентов в чистом состоянии, что бывает очень редко. Если ![]() , то есть компонент первый при данной температуре более летуч, то пар будет обогащен по сравнению с жидкостью именно этим компонентом, то есть
, то есть компонент первый при данной температуре более летуч, то пар будет обогащен по сравнению с жидкостью именно этим компонентом, то есть ![]() . В случае совершенных растворов пар всегда обогащен по сравнению с жидкостью компонентом, давление насыщенного пара которого выше, то есть более летучим компонентом.
. В случае совершенных растворов пар всегда обогащен по сравнению с жидкостью компонентом, давление насыщенного пара которого выше, то есть более летучим компонентом.
