Теория структурообразования
где А, В – постоянные величины, которые могут быть рассчитаны;
ε – диэлектрическая проницаемость среды;
Z – заряд иона-коагулянта;
ē – заряд электрона.
Из этой формулы видно, что зависимость порога коагуляции от заряда иона-коагулянта, выведенная из теории ДЛФО, согласуется с эмпирическим правилом Шульце-Гарди:
![]() .
.
Жидкообразные и твердообразные тела. Ньютоновские и неньютовские жидкости. Псевдопластические и дилатантные жидкообразные тела. Уравнение Оствальда-Вейля. Бингамовские и небингамовские твердообразные тела. Тиксотропия и реопексия
Предложенная П.А. Ребиндером классификация структур дисперсных систем помогает связать механические свойства тел с их строением.
В соответствии с реологическими свойствами все реальные тела делят на жидкообразные (предел текучести равен нулю, РТ = 0) и твердообразные (РТ > 0).
Жидкообразные тела классифицируют на ньютоновские и неньютоновские жидкости. Ньютоновские жидкости – это системы, вязкость которых не зависит от напряжения сдвига и является постоянной величиной в соответствии с законом Ньютона. Течение неньютоновских жидкостей не следует закону Ньютона, их вязкость зависит от напряжения сдвига. Неньютоновские жидкости подразделяются на стационарные, реологические свойства которых не меняются во времени, и нестационарные, для которых эти характеристики зависят от времени. Неньютоновские стационарные жидкости подразделяются на псевдопластические и дилатантные (рис. 4.1.2.1 и 4.1.2.2).
Исходя из экспериментальных исследований, графические зависимости напряжения сдвига от скорости деформации в логарифмических координатах часто линейны и различаются только тангенсом угла наклона прямой, поэтому общую зависимость напряжения сдвига Р от скорости деформации g можно выразить в виде степенной функции:
![]() ,
,
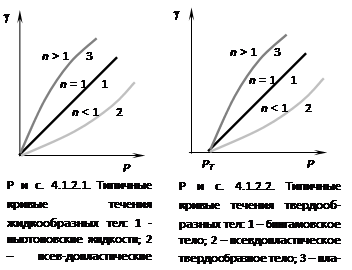 где k и n – постоянные, характеризующие данную жидкообразную систему.
где k и n – постоянные, характеризующие данную жидкообразную систему.
Двухпараметрическое уравнение – математическая модель Оствальда-Вейля: ньютоновская вязкость h неньютоновской стационарной жидкости определяется уравнением
![]() .
.
При n = 1 жидкость ньютоновская (кривая 1 рис. 4.1.2.1). Отклонение n от 1 характеризует степень отклонения свойств жидкости от ньютоновских.
Разбавленные дисперсные системы с равноосными частицами обычно – ньютоновские жидкости. Псевдопластические жидкости – суспензии с асимметричными частицами, растворы полимеров производные целлюлозы). Дилатантные жидкости в химической технологии встречаются редко, их свойствыа характерны для некоторых керамических масс. Дилатантное поведение наблюдается у дисперсных систем с большим содержанием твердой фазы.
Теория быстрой коагуляции, разработанная М. Смолуховским в 1916 г., основана на следующих положениях.
1. Рассматриваемая система является монодисперсной, радиус частиц r.
2. ![]() , т.е. все столкновения являются эффективными.
, т.е. все столкновения являются эффективными.
3. Рассматриваются только столкновения первичных частиц.
4. Кинетика коагуляции подобна кинетике бимолекулярной реакции:
![]() ,
,
где k – константа скорости коагуляции.
Проинтегрируем это уравнение, разделив переменные:
![]()
![]() ,
,
где u0 – концентрация частиц золя в начальный момент времени;
ut – концентрация частиц золя в момент времени t.
Для характеристики быстрой коагуляции используется период коагуляции(период половинной коагуляции) q.
Период коагуляции (q) – это время, через которое концентрация коллоидных частиц уменьшается в два раза.
При ![]()
![]()
Согласно теории быстрой коагуляции, константа коагуляции зависит от коэффициента диффузии и может быть вычислена по уравнению
![]()
Если подставить в это уравнение величину коэффициента диффузии, получим:
![]()
Таким образом, зная вязкость дисперсионной среды и температуру, можно вычислить константу скорости быстрой коагуляции. Теория Смолуховского неоднократно проверялась экспериментально и получила блестящее подтверждение, несмотря на сделанные автором допущения.
Медленная коагуляция связана с неполной эффективностью столкновений вследствие существования энергетического барьера. Простое введение величины степени коагуляции a в формулы теории Смолуховского не привело к согласию теории с опытом. Более совершенную теорию медленной коагуляции разработал Н.Фукс. Он ввел в кинетическое уравнение коагуляции множитель, учитывающий энергетический барьер коагуляции ΔU к:
![]() ,
,
где kКМ – константа скорости медленной коагуляции;
kКБ - константа скорости быстрой коагуляции;
Р – стерический фактор;
ΔUк - потенциальный барьер коагуляции;
k – постоянная Больцмана.
Таким образом, для расчета константы скорости медленной коагуляции необходимо знать потенциальный барьер коагуляции, величина которого зависит прежде всего от z– потенциала.
Фактор устойчивости, или коэффициент замедления W, показывает, во сколько раз константа скорости медленной коагуляции меньше константы скорости быстрой коагуляции.
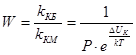 ,
,
Следует отметить пять факторов устойчивости, среди которых два первых играют главную роль.
1. Электростатический фактор устойчивости.
Он обусловлен наличием ДЭС и x– потенциала на поверхности частиц дисперсной фазы.
2. Адсорбционно – сольватный фактор устойчивости.
Он обусловлен снижением поверхностного натяжения в результате взаимодействия дисперсионной среды с частицей дисперсной фазы. Этот фактор играет заметную роль, когда в качестве стабилизаторов используются коллоидные ПАВ.
3. Структурно – механический фактор устойчивости.
Он обусловлен тем, что на поверхности частиц дисперсной фазы образуются пленки, обладающие упругостью и механической прочностью, разрушение которых требует времени и затраты энергии. Этот фактор устойчивости реализуется в тех случаях, когда в качестве стабилизаторов используются высокомолекулярные соединения (ВМС).
4. Энтропийный фактор устойчивости.
Коагуляция приводит к уменьшению числа частиц в системе, следовательно, к уменьшению энтропии (ΔS<0), а это приводит к увеличению свободной энергии системы ΔG>0. Поэтому система самопроизвольно стремится оттолкнуть частицы друг от друга и равномерно (хаотично) распределить по объему системы. Этим обусловлен энтропийный фактор устойчивости. Однако число частиц в коллоидном растворе по сравнению с истинным раствором такой же массовой концентрации гораздо меньше, поэтому роль энтропийного фактора невелика. Но если частицы стабилизированы веществами, обладающими длинными гибкими цепями (ВМС) и потому имеющими много конформаций, то при сближении таких частиц их защитные слои вступают во взаимодействие. Это взаимодействие непременно приводит к уменьшению числа возможных конформаций, а значит – к уменьшению энтропии. Поэтому система стремится оттолкнуть частицы друг от друга.
