Тепловые эффекты химических реакций
Равновесие жидкость — газ
|
i |
|
|
|
|
|
|
|
|
1 |
1826 |
7,50988 |
277,2 |
0,00360 |
1,296×10–5 |
0,0270 |
1836,324 |
|
2 |
2082 |
7,64108 |
279,2 |
0,00358 |
1,281×10–5 |
0,0273 |
2071,554 |
|
3 |
2372 |
7,77148 |
281,4 |
0,00355 |
1,260×10–5 |
0,0275 |
2360,579 |
|
4 |
2626 |
7,87321 |
283,2 |
0,00353 |
1,246×10–5 |
0,0277 |
2622,843 |
|
5 |
2932 |
7,98344 |
285,2 |
0,00350 |
1,225×10–5 |
0,0279 |
2943,963 |
|
6 |
3279 |
8,09529 |
288,7 |
0,00346 |
1,197×10–5 |
0,0281 |
3589,551 |
|
n = 6 |
46,874 |
0,02122 |
7,511×10–5 |
0,1655 |
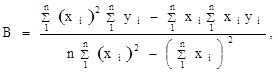
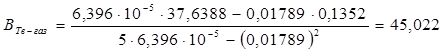
![]()
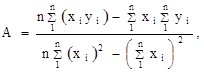
![]()
![]()
где n — число измерений. При использовании данных таблицы получим:
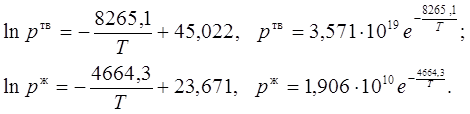
2. Из полученных уравнений рассчитываем среднюю теплоту испарения и возгонки:
![]()
![]() .
.
Теплоту плавления вещества в тройной точке найдем по закону Гесса:
DНпл = DНвозг – DНисп = 68716,04−38776,49=29939,55 Дж/моль.
3. Вычислим dT/dp в тройной точке из уравнения:
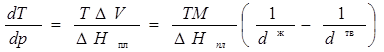
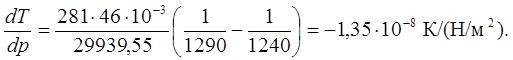
Координаты тройной точки определяем совместным решением уравнений:
Ттр.т = 281 К; Ртр.т = 2289,5 Н/м2.
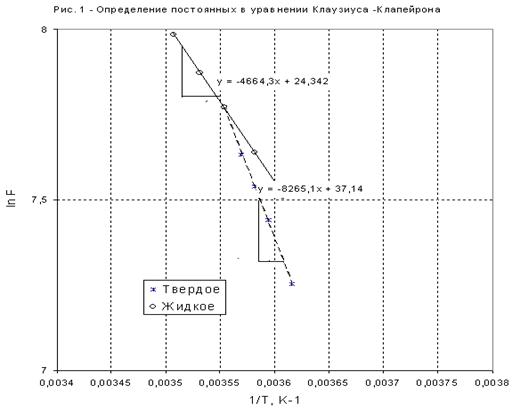
4. На рис. 4 приведены кривые зависимостей давлений насыщенного пара от температуры для твердого и жидкого вещества, рассчитанные по уравнениям . Эти линии определяют параметры фазовых равновесий «тв ® газ» и «ж ® газ». При имеющейся информации линию фазовых равновесий «тв ® ж» проводим с учетом углового коэффициента этой линии в тройной точке
![]() ,
,
который считается независящим от давления (температуры). Получается практически вертикальная линия с неуловимым наклоном вправо. На диаграмме представлены исходные экспериментальные данные.
5. Температуру плавления вещества при давлении ![]() вычислим по формуле:
вычислим по формуле:
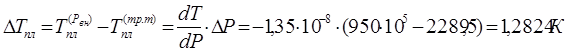
Отсюда ![]()
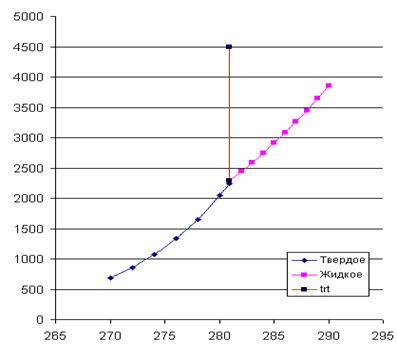
Рис. 2. Температурная зависимость давлений насыщенного пара для твердого и жидкого вещества
Нормальную температуру кипения вещества оценим, подставив в уравнение ![]() . Получим
. Получим
![]()
6. Изменение термодинамических функций для процесса равновесной возгонки 1 моля вещества при условиях трехфазного равновесия составят:
|
Энергии Гиббса |
|
|
Энергии Гельмгольца |
|
|
Энтальпии |
|
|
Внутренней энергии |
|
Самостоятельная работа № 3
Вариант № 8
