Термодинамика поверхностного слоя
c – концентрация поверхностно-активного вещества (ПАВ);
А, b – константы, данные в справочнике.
Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
Запишем известное из термодинамики выражение внутренней энергии для поверхности.
![]() Us =
Us = ![]() Gs + T
Gs + T![]() SS - уравнение полной поверхностной энергии.
SS - уравнение полной поверхностной энергии.
В этом уравнении qs = TDS - теплота образования единицы поверхности в обратимом процессе. Она равна количеству теплоты, которую необходимо подвести к системе, чтобы увеличить ее поверхность на единицу при T=const. Из уравнений фазы при постоянстве всех параметров, кроме температуры, имеем:
dGs = - SsdT,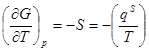 .
.
Подставляя эти значения в уравнение полной поверхностной энергии, получаем:
![]() - уравнение Гиббса - Гельмгольца для поверхности.
- уравнение Гиббса - Гельмгольца для поверхности.
Оно связывает полную поверхностную энергию с энергией Гиббса (поверхностное натяжение).
Для гетерогенной системы изменение внутренней энергии, исходя из I и II начал термодинамики:
dU =TdS – pdV +![]() dS +
dS +![]() idni +jdq,
idni +jdq,
где dU - изменение внутренней энергии;
dS - изменение энтропии;
dV - изменение объема;
Т – температура;
Р – давление;
![]() - поверхностное натяжение;
- поверхностное натяжение;
n - число молей компонента;
dq - изменение электрического заряда;
![]() - химический потенциал компонентов;
- химический потенциал компонентов;
![]() - электрический потенциал компонентов;
- электрический потенциал компонентов;
S - межфазная поверхность.
При S, V, n, q=const уравнение примет вид: dU =![]() dS
dS ![]()
![]() ,
,
т.е. ![]() - это изменение энтропии на единицу площади.
- это изменение энтропии на единицу площади.
Из уравнений видно ![]() , т.е. подтверждается, что при увеличении температуры поверхностное натяжение снижается. Если сопоставить изменение
, т.е. подтверждается, что при увеличении температуры поверхностное натяжение снижается. Если сопоставить изменение ![]() , qs,
, qs, ![]() Us от температуры, получим рис. 2.1.2.3. Из графика видно, что величина DUs для индивидуального вещества величина практически постоянная т.е. DUs не зависит от температуры. Для расчета зависимости
Us от температуры, получим рис. 2.1.2.3. Из графика видно, что величина DUs для индивидуального вещества величина практически постоянная т.е. DUs не зависит от температуры. Для расчета зависимости ![]() = f(T) используются эмпирические и полуэмпирические зависимости - метод парохор, формула Этвеша.
= f(T) используются эмпирические и полуэмпирические зависимости - метод парохор, формула Этвеша.
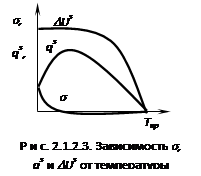
В случае твердых фаз процесс образования новой поверхности носит необратимый характер и ![]() (поверхностное натяжение) можно изменить только косвенным путем, например, путем расчета. Мерой количественного выражения свободной энергии является f или G. В соответствии со вторым законом термодинамики для самопроизвольных процессов,
(поверхностное натяжение) можно изменить только косвенным путем, например, путем расчета. Мерой количественного выражения свободной энергии является f или G. В соответствии со вторым законом термодинамики для самопроизвольных процессов,
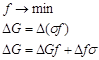
Возможны два варианта:
1.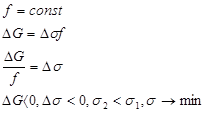 2.
2.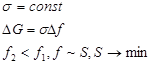
Отсюда следует, что в дисперсных системах в самопроизвольных процессах поверхность (а, следовательно, и поверхностное натяжение) уменьшается.
