Термодинамическая система и термодинамические функции
Идеальный кристалл со строго упорядоченным расположением всех атомов – очень маловероятная структура, которая может поддерживаться лишь при наличии больших межатомных сил или, иначе говоря, при низком уровне его внутренней энергии. При нагревании кристалла тепловое движение нарушает эту упорядоченность. При определенной температуре (точке плавления), когда тепловая энергия становится больше энергии межатомного взаимодействия, твердая кристаллическая решетка разрушается и вещество переходит в менее упорядоченное жидкое состояние. Свободная энергия, которой характеризуется равновесное состояние [формула (5)], определяется соотношением между упорядочивающим действием внутренней энергии и разупорядочивающим действием повышенной температуры, причем энтропия служит количественной мерой действия температуры.
Равновесие. Таким образом, условием равновесия при постоянной внутренней энергии является максимум энтропии S. Возможны некоторые флуктуации, кратковременно выводящие систему из этого состояния, но в среднем за любое достаточно длительное время выполняется равенство
dS = 0.
Поскольку величины F и G являются функциями энтропии S, взятой со знаком «минус», данное условие означает, что равновесие возможно только тогда, когда либо величина F, либо величина G имеет минимум. Таким образом, при любом мыслимом изменении dX условия равновесия таковы:
![]()
или
![]()
Аналогично
![]()
или
![]()
Изменение dX может представлять собой увеличение объема, уменьшение площади поверхности, сокращение длины, увеличение электрического заряда, уменьшение намагниченности или увеличение числа молекул. Энергетическая функция тогда должна иметь еще более общую форму, нежели потенциал Гиббса G, а для того, чтобы равновесие было устойчивым, все другие переменные – внутренняя энергия, энтропия, температура, давление, поверхностное натяжение, электрический потенциал, напряженность магнитного поля, химический потенциал – должны изменяться в строгом согласии с уравнением (20). Такова обобщенная формулировка принципа динамического равновесия, установленного в 1884 французским химиком А.Ле Шателье (1850–1936). Введенный им принцип гласит: «Если на систему, находящуюся в устойчивом равновесии, оказывается внешнее воздействие, то в системе происходит такое смещение равновесия, которое ослабляет это воздействие».
Термодинамические соотношения. Дифференцируя уравнения, связывающие термодинамические функции между собой, и привлекая другие фундаментальные законы, можно вывести некоторые важные соотношения между такими функциями.
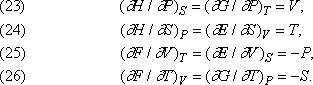
Уравнения (23)–(25) лучше проясняют физический смысл функций E, H, F и G в их связи с более привычными переменными V, T и P. Уравнение же (26), как уже говорилось, дает еще одну интерпретацию энтропии S с использованием функции F или G.
Дж.Максвелл (1831–1879) вывел следующие важные соотношения между переменными V, T, P и S:
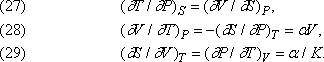
Здесь a – коэффициент теплового расширения, отнесенный к единице объема при постоянном давлении, т.е. (1/V)(¶ V/¶Т)P, а K – изотермическая сжимаемость -(1/V)(¶ V/¶P)T.
Применение соотношений Максвелла. Из соотношений Максвелла можно вывести другие интересные соотношения. Например, можно вычислить теплоту парообразования L некоторой жидкости, чтобы выяснить, как она зависит от изменения объема при испарении. В первой части двойного равенства (29) величину ¶ S можно приравнять L/T. Изменение объема dV равно разности (V- v) объема пара V и объема жидкости v при температуре T, которая в данном случае, конечно, равна точке кипения жидкости при нормальном атмосферном давлении P. Следовательно,
![]()
Это соотношение было выведено путем анализа теплового цикла, предложенного французским инженером Б.Клапейроном (1799–1864) в 1834. Оно показывает, что теплоту парообразования необязательно определять калориметрическими методами; ее можно вычислить по расширению, происходящему при испарении, если известна скорость повышения давления насыщенного пара жидкости при повышении температуры, когда поддерживается постоянным объем системы. Это типичное уравнение термодинамики, устанавливающее соотношение между казалось бы не связанными друг с другом переменными.
Путем аналогичных рассуждений Р.Клаузиус (1822–1888) вывел выражение для разности теплоемкостей Cs твердой и Cl жидкой фаз:
![]()
которое, впрочем, проще вывести из соотношения (15).
Поскольку он рассматривал уравнение Клапейрона и внес, по его словам, «небольшие изменения» в ход рассуждений, за соотношением (30) укрепилось название уравнения Клаузиуса – Клапейрона.
Рассуждая в какой-то мере аналогично, можно, пользуясь первым из соотношений Максвелла, вывести формулу, показывающую влияние давления на температуру плавления твердого вещества, теплоизолированного так, что его энтропия постоянна:
![]()
Здесь L – теплота плавления, T – температура плавления при данном давлении P, а (Vl – vs) – изменение объема твердого вещества при плавлении. В случае льда при плавлении происходит сжатие, и формула (32) показывает, что с повышением давления температура плавления понижается. Опытные данные согласуются с результатами вычислений. Большинство других твердых веществ при плавлении расширяется, и, следовательно, их температуры плавления повышаются с повышением давления.
Влияние давления. Другие эффекты, связанные с изотермическим изменением давления, описываются формулами
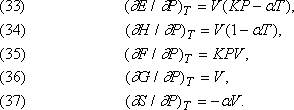
Эффект Джоуля – Томсона. Если газ находится в теплоизолированном сосуде и над ним не совершается работа (H = const), то изменение его температуры, обусловленное изменением давления, дается формулой
![]()
Для идеального газа aT = 1, и поэтому его температура не должна изменяться. Следовательно, по изменению температуры, измеренному, например, при расширении газа в вакуум, можно оценивать степень отклонения реального газа от идеального. Такой эффект действительно наблюдается, и по имени ученых, открывших его, называется эффектом Джоуля – Томсона.
Влияние температуры. Точно так же выводятся формулы, описывающие влияние температуры при постоянном давлении:
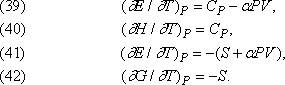
Другие соотношения. Разность теплоемкостей при постоянном давлении и при постоянном объеме дается выражением
