Титрование с применением окислительно-восстановительной реакции
При выборе вещества титранта в редоксиметрии проводят качественную и количественную оценку возможности (направленности) и полноты прохождения ОВР между титрантом и определяемым веществом.
Качественную оценку проводят путем сравнения табличных величин E(OX|Red) вещества титранта и определяемого вещества, приведенных в аналитических, химических и физико-химических справочниках. При этом руководствуются следующими правилами:
а) окисленная форма вещества редокс-пары с большим E играет роль окислителя по отношению к восстановленной форме вещества редокс-пары с меньшим E;
б) чем больше E, тем чётче выражена окислительная способность окисленной формы редокс-пары;
в) ОВР протекает в заданном направлении, если ЭДС= E(OX1/Red1) - E(OX2/Red2) > 0, причем чем больше ЭДС, тем интенсивней ОВР;
г) ОВР идут в сторону образования более слабых окислителей и восстановителей.
Количественной характеристикой направления и полноты протекания ОВР является её константа равновесия Кравн. Формулу для расчета Кравн можно вывести из условия установления состояния равновесия в редокс-системе, когда E(OX1/Red1) становится равным E(OX2/Red2). В этот момент
![]()
![]() .
.
После преобразования этого равенства получим
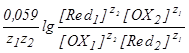
E(OX1/Red1) - E(OX2/Red2) = .
В этой формуле под знаком логорифма стоит выражение для Кравн., поэтому
lgKравн=![]() .
.
ОВР протекает в прямом направлении при Кравн>1 и тем полнее, чем больше Кравн. При Кравн ≥ 103 ОВР практически необратима.
Особенностью ОВР является сложный характер, определяемый многостадийностью с образованием промежуточных, часто нестойких и высокоактивных продуктов. Например, реакция окисления йодидионов пероксидом водорода, представляемая суммарным уравнением
2I-+H2O2+2H+ I2+2H2O, в действительности протекает в несколько стадий:
I-+H2O2 IO-+H2O
IO-+H+ HIO
HIO+I-+H+ I2+H2O
Скорость ОВР мала. Увеличить её можно повышением температуры до 100С или введением катализаторов. В качестве катализатора могут выступать Н+ - ионы. Катализаторы действуют на ОВР весьма специфично, ускоряя одни и не ускоряя другие. Например, окисление I - ионов ускоряет МnО4-, катализатором восстановления Ge4+ является OsO4, а MnO4 - OsO4 и KI.
Катализатором может быть продукт самой ОВР. Например, образующиеся ионы Mn2+ ускоряют реакцию
2MnO4+5C2O42-+16H+2Mn2++10CO2+8H2O.
Подобные реакции называют автокаталитическими.
Существенные осложнения в анализе могут вызвать образующиеся в ходе ОВР промежуточные высокоактивные соединения, способные вступать в побочные реакции. Типичным примером является перманганатометрическое определение Fe2+ в солянокислом растворе. В этом случае наблюдается повышенный расход KМnO4 по сравнению с титрованием в среде серной кислоты. Причиной является расход части количества KMnO4 на окисление Cl - ионов соляной кислоты до свободного Cl2:
2MnO4-+ 10Cl-+16H+2Mn2++5Cl2+8H2O,
причем в отсутствие ионов Fe2+ эта реакция не идет. Реакции подобного типа, не идущие одна без другой, Н.А. Шилов назвал сопряженными или индуцированными. При взаимодействии ионов MnO4 - и Fe2+ образуются неустойчивые соединения марганца в промежуточных степенях окисления: Mn(V), Mn(IV), Mn(III), которые, обладая высокой химической активностью, окисляют не только ионы Fe2+, но и Cl - ионы. Образовавшийся Cl2 частично улетучивается из раствора, что увеличивает расход KMnO4 на титрование Fe2+ - ионов.
Вещество, участвующее в обеих сопряженных реакциях, называется актором (в рассмотренном примере - MnO4-), вещество, реагирующее непосредственно с актором - индуктор (Fe2+), а реагирующее с актором только в присутствии индуктора - акцептор (Cl-).
Для предотвращения индуцированного окисления Cl - в присутствии Fe2+ рекомендуется при титровании раствором KМnO4 в титруемый раствор вводить MnSO4. Введенные ионы Mn2+ значительно легче окисляются неустойчивыми соединениями марганца до Mn7+, чем Cl - до Cl2, предотвращая газообразование хлора, поэтому взаимодействие ионов MnO4 и Fe2+ становится химически эквивалентным.
Перманганатометрия - безындикаторный метод. В ней окончание титрования устанавливают по порозовению титруемого раствора в КТТ при избытке раствора KМnO4, остальные редоксиметрические методы - индикаторные.
Правильный выбор редокс-индикаторов для регистрации КТТ редокс-титрования проводят по соответствующим ТКТ, которые строят на основе расчета редокс-потенциалов для различных моментов титрования. Точку “до начала титрования“ не рассчитывают, так как без добавления титранта к титруемому раствору ОВР не идет и редокс-система не образуется. Точки ТКТ “до ТЭ” рассчитывают по уравнению Нернста для той редокс-пары, в которою входит определяемое вещество, а “после ТЭ” - по уравнению для редокс-пары титранта. Потенциал в ТЭ вычисляют по формуле
Eэкв = ![]() .
.
Расчеты могут быть значительно упрощены, если в формулу Нернста вместо соотношения концентраций ввести степень оттитрования . (табл.1.9.1)
Таблица 1.9.1
|
Участок ТКТ |
Титруемое вещество | |
|
восстановитель |
окислитель | |
|
До ТЭ После ТЭ |
E=E1+ |
E=E1+ |
Величина скачка титрования на редокс-ТКТ тем больше, чем больше разность потенциалов редокс-пар и концентрации анализируемого раствора и титранта. Принцип выбора редокс-индикатора по ТКТ тот же, что и в протолиметрии.
Изменение окраски редокс-индикаторов происходит под действием окислителя или восстановителя, сдвигающего равновесие между окисленной и восстановленной формами индикатора при изменении потенциала редокс-системы:
Ind(OX) +ze - Ind(Red).
Потенциал редокс-пары Ind(OX) /Ind(Red) может быть вычислен по уравнению Нернста:
E = E+![]() .
.
Учитывая, что изменение цвета раствора на глаз наиболее различимо, когда концентрация одной из форм индикатора в десять и более раз превышает концентрацию другой, т.е. при 1/10 [Ind(OX)] / [Ind(Red)] 10/1, после подстановки этого соотношения в формулу Нернста и преобразований получим интервал перехода редокс-индикатора в вольтах:
