Факторы, влияющие на результаты полярографических измерений
Поскольку предельный диффузионный ток, согласно уравнению Iд = КС, пропорционален концентрации, то амперометрические кривые титрования, построенные в координатах Iд - V, являются линейными (рис.2.14.4). По ним графически находят объем титранта в точке эквивалентности (Vэкв).
Значение напряжения, при котором следует проводить титрование, предварительно устанавливают по полярограммам анализируемого раствора, титранта или раствора продуктов реакции.
Если электроактивным является вещество титранта, то ток останется практически равным нулю, пока не будет достигнута конечная точка титрования и не появится в растворе избыток титранта. Начиная с этого момента, ток будет расти. Такую кривую титрования можно получить, напри - мер, при титровании ионов цинка раствором K4 [Fe(CN) 6], окисляющегося на платиновом электроде (рис. 6, а).
Титрование возможно, если электроактивен образующийся продукт реакции определяемого вещества и титранта. Кривая титрования тогда имеет вид, изображенный на рис. 6, б.
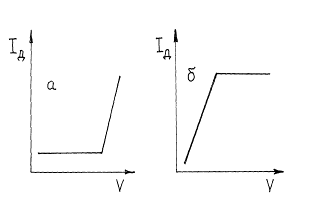
Рис. 6. Кривые амперометрического титрования при электроактивном титранте (а) или продукта реакции титрования (б).
Для амперометрического титрования пригодны реакции комплексообразования, осаждения, а также редоксиреакции. Концентрация титруемого раствора обычно порядка 10-3 моль/л. Определять можно не только неорганические, но и органические вещества (например, фенолы). Метод значительно проще, экспресснее и доступнее полярографии и вольтам перометрии.
Инверсионная вольтамперометрия (вольтамперометрия с накоплением) - это метод, отличающийся от других не формой используемого импульса, а принципом проведения анализа. Исследуемое вещество сначала частично или полностью осаждают электрохимическим путем из пробы раствора на инертный электрод-подложку (стадия накопления, концентрирования). Чаще всего этот метод применяют для катионов металлов, которые катодно осаждают на стационарном (не капающем!) ртутном электроде или на платиновых, золотых, графитовых и т.д. твердых индифферентных электродах. На второй стадии, после извлечения ионов из раствора, электрод с пленкой осажденного металла подвергают анодной поляризации с линейно изменяющимся (с постоянной скоростью) потенциалом.
При превышении в ходе поляризации равновесного значения потенциала, отвечающего определяемому металлу, он начинает растворяться, причем тем активнее, чем больше поляризующее напряжение. Соответственно с этим растет регистрируемый самописцем-потенциометром ток растворения. Выходная кривая (вольтамперограмма) данного метода имеет вид кривой с максимумом, отвечающим окончанию растворения концентрата и выходу фронта растворения на поверхность индифферентного электрода (рис.2.14.6).
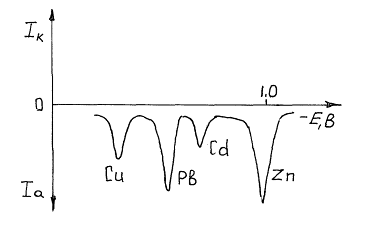
Рис. 6, б. Инверсионная вольтамперограмма раствора, содержащего цинк, кадмий, свинец и медь (фон 0,1 М НСООН, Енакоп =1,2 В).
Положение и высота максимумов тока на вольтамперограмме характеризуют как природу, так и общее количество (концентрацию) исследуемого вещества. В присутствии нескольких определяемых веществ в специально подобранных условиях (фоновый электролит, потенциал накопления и т.д.) на кривой можно получить несколько максимумов тока, отвечающих каждому веществу. Данный метод чрезвычайно чувствителен - в отдельных случаях могут быть обнаружены примеси металлов с концентрацией 10-9 моль/л и даже ниже. Необходимо иметь в виду, что при очень малых концентрациях для полного осаждения ионов из раствора требуется значительное время накопления - иногда до одного часа, но этот недостаток нивелируется простотой применяемого оборудования. Для определения неизвестной концентрации применяют в основном метод стандартной серии или метод добавок.
Электрогравиметрия (ЭГМ) является разновидностью гравиметрии. Особенность ЭГМ заключается в осаждении определяемого элемента путем электролиза на предварительно взвешенном электроде. О массе элемента в растворе судят по увеличению массы электрода после электролиза.
ЭГМ применяют для определения металлов из растворов, в которых они присутствуют в виде ионов.
При электролизе катионы перемещаются к катоду, выделяясь на нем в виде металлов. Только очень немногие металлы осаждаются на аноде. К ним относятся, например, Mn и Pb, окисляющиеся в процессе электролиза до MnO2 и PbO2.
ЭГМ применяют для определения металлов, дающих плотные осадки на электроде, не осыпающиеся при промывании, высушивании и взвешивании. Кроме того, ЭГМ применяют только в тех случаях, когда осаждение определяемого металла не сопровождается соосаждением других металлов или примесей.
Электроды, применяемые в ЭГМ, должны отвечать следующим требованиям:
1) быть химически инертными;
2) хорошо удерживать образующиеся осадки;
3) иметь возможно меньшую массу и возможно большую поверхность;
4) не препятствовать перемешиванию раствора.
Всем этим требованиям в наибольшей степени удовлетворяют платиновые сетчатые электроды. Анодом, в большинстве случаев, служит платиновая проволока, согнутая в спираль.
Для проведения ЭГМ два платиновых электрода погружают в стакан с анализируемым раствором, подсоединяют электроды к внешнему источнику тока и проводят электролиз. При прохождении тока через раствор электролита происходят процессы восстановления и окисления соответствующих веществ на электродах. Связь между количествами веществ, участвующих в электродных процессах, и количеством электричества Q (Q = It) через цепь за время электролиза t при токе I устанавливается двумя законами Фарадея:
1) масса вещества, выделившаяся при электролизе, пропорциональна количеству электричества, прошедшего через раствор;
2) при прохождении через раствор одного и того же количества электричества на электродах выделяется одно и то же количество вещества эквивалента.
Математически оба закона можно представить формулой
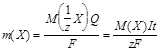 ,
,
где m(X) - масса вещества X, выделившегося при электролизе;
M(1/z X) и M(X) - молярная масса эквивалента и молярная масса вещества X, соответственно;
z - число эквивалентности;
F - число Фарадея, равное количеству электричества (96500 Кл), которое требуется для выделения 1 моль эквивалентов вещества.
Формула позволяет решать различные задачи, связанные с электролизом. Например, вычислить продолжительность при заданной силе тока для выделения определенной массы вещества. На практике электролиз требует больше времени, чем это следует из формулы. Это связано с побочными реакциями, обычно сопровождающими главные. Поэтому КПД тока, иначе называемый выходом по току, почти всегда ниже 100%.
Выход по току может быть определен как отношения массы вещества m, реально полученного при электролизе, к массе вещества, которая могла бы получиться в соответствии с законом Фарадея m0, если бы количество электричества не расходовалось на побочные процессы:
