Физическая связь
Ориентационные взаимодействия Ван-дер-Ваальса
(эффект Кезома)
 Рассмотрим возможные силы взаимодействия между двумя диполями…
Рассмотрим возможные силы взаимодействия между двумя диполями…
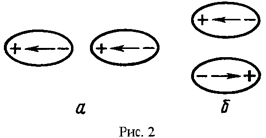
Если два диполя расположены на одной прямой и одинаково ориентированы (см. рис. 2а), то они притягиваются с силой обратно пропорциональной третьей степени расстояния между ними, установка диполей в "хвост". Аналогичная сила действует между двумя противоположно направленными диполями, расположенными на параллельных прямых, на кратчайшем расстоянии друг от друга (см. рис. 2б), установка диполей "один под другим" (антипараллельная установка диполей). В обоих случаях они ориентируются так, чтобы энергия системы стала минимальной (см. рис. 2). Если диполи ориентированы не так, как показано на рис. 2 то между диполями кроме силы радиального взаимодействия (притяжение либо отталкивание) возникает крутящий момент.
Пусть расстояние между центрами диполей (s) намного больше длинны диполя (l). Заряд разнесенный в диполе на расстояние l обозначим через e. Тогда энергию ориентационного взаимодействия можно представить как алгебраическую сумму кулоновского притяжения и отталкивания зарядов полюсов диполей:
|
Uор |
= | ¾ | e2 | ¾ | e2 | + | 2e2 |
= | ¾ | 2e2l2 | . |
| s-l | s+l | s | (s2-l2)s |
Пренебрегая величиной l2 по сравнению с s2 в знаменателе и обозначая через m дипольный момент (m=el), получаем: Uop--= - 2m2/s3. Для двух разных полярных молекул с моментами m1 и m2 такой же расчет дает Uop= ‑2m1m2/s3. При установке диполей один под другим (см. рис.2)
|
Uор |
= | ¾ 2 | e2 | + 2 | e2 |
= | -2e2(s2+l2)+ 2e2s(s2+l2)1/2 | . |
| s | (s2+l2)1/2 | (s2+l2)s |
Учитывая, что l2<<s2 , воспользуемся приближенным равенством (s2+l2)1/2 @ s+l2/2s . Тогда
|
Uop |
= – | e2l2 |
, откуда следует: Uopçç=-m2/s3. Выше упомянутые формулы справедливы для расчета |
|
(s2+l2)s |
Энергии ориентационного взаимодействия тогда, когда тепловое движение не расстраивает ориентацию молекул, т.е. когда Uop>>kT. Поэтому они пригодны для расчета энергии лишь в молекулярных кристаллах, где положение молекул фиксировано. В жидкостях и газах тепловое движение приводит ко всевозможным ориентациям молекул. При усреднении энергии взаимодействия по всем возможным ориентациям с учетом теплового движения, для жидкостей и газов получаем следующую формулу:
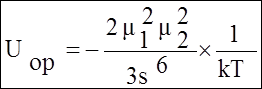
Для полярных молекул вклад ориентационного взаимодействия в энергию межмолекулярного взаимодействия жидкостей можно оценить, не зная конкретных расстояний между молекулами. В полярном диэлектрике на молекулу действует эффективное поле, создаваемое всеми остальными молекулами Eэфф. Понижение энергии одного моля частиц при этом W=-½NAmEэфф . (Множитель ½ введен чтобы не учитывать взаимодействие одной пары частиц дважды.) Эффективное поле можно выразить через диэлектрическую проницаемость e и показатель преломления среды nD, в результате чего получим:
![]()
Вычисленные по этой, очень приближенной формуле значения W показывают, что ориентационный вклад в энергию сцепления полярных жидкостей весьма существенен, но все же как правило меньше вклада дисперсионных сил. Это объясняется тем, что по сравнению с общим случаем электростатических взаимодействий (например ионное взаимодействие) аддитивностью ориентационных взаимодействий можно пренебречь, т.к. взаимная ориентация двух диполей мешает им ориентироваться относительно третьего. Поэтому эффект ориентационного взаимодействия уступает действию значительно более аддитивных вследствие гибкости дисперсионных связей дисперсионных взаимодействий (речь о дисперсионных взаимодействиях пойдет ниже). Вклад ориентационного взаимодействия в энергию сцепления полярных жидкостей является преобладающим лишь для наиболее полярных молекул, например для воды.
Ориентационные взаимодействия Ван-дер-Ваальса играют определяющую роль в процессах электролитической диссоциации. Для наиболее полярных веществ связи Ван-дер-Ваальса ориентационной природы вносят наиболее существенный вклад в значения энергии и температуры плавления и сублимации (или кипения). Ориентационные взаимодействия Ван-дер-Ваальса, наряду с ван-дер-ваальсовыми индукционными взаимодействиями используются в абсорбционных и адсорбционных пылеочистных сооружениях (поэтому в качестве абсорбатов и адсотбатов в пылеочистных сооружениях практически всегда используются именно сильнополярные материалы.
Индукционные взаимодействия Ван-дер-Ваальса
(эффект Дебая)
Молекула, обладающая постоянным дипольным моментом, наводит в другой молекуле, неполярной или полярной, так называемый индуцированный дипольный момент. Величина индуцированного электрическим полем напряженности E дипольного момента mинд может быть представлена следующим рядом: mинд = aE+bE2+¼ . Для электрических полей малой напряженности можно пренебречь всеми членами ряда, кроме первого, это приближение можно сделать для пары индукционно взаимодействующих диполей. mинд = aE, где a - поляризуемость молекулы. Индуцированный дипольный момент имеет то же направление, что и линии напряженности электрического поля постоянного диполя вызвавшего появление наведенного дипольного момента у поляризуемой молекулы или радикала в точке нахождения поляризуемой молекулы (или соответственно радикала). Взаимодействие постоянного диполя одной молекулы (радикала, сложного иона) и наведенного им диполя второй молекулы (или вообще группы атомов) понижает потенциальную энергию системы из двух молекул и упрочняет систему.
