Формальная кинетика сложных реакций
Пример 1.1 (относительно простой)
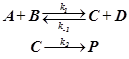
протекает по двум или более путям. Этот принцип чрезвычайно важен при анализе внутримолекулярных процессов типа циклических движений марковских перескоков в виде трёхпозиционного вращения.
См. примеры.
Пример 3.1. Рассмотрим кинетическую схему реакции: 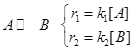
и ту же самую реакцию в присутствие протонов: 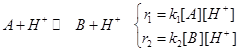
Скорость реакции равна: ![]()
И в условиях равновесия приходим к сомнительному результату вида:
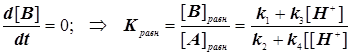 (4.7)
(4.7)
Возникает парадокс, согласно которому константа равновесия, вопреки незыблемым установкам термодинамики, выглядит зависимой от концентрации протонов. Для его устранения вводится принцип детального равновесия. Он состоит в том, что система кинетических уравнений дополняется условиями детального равновесия:
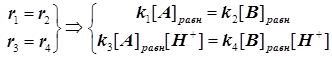 (4.8)
(4.8)
В результате концентрация протонов исчезает из выражения константы скорости, а именно:
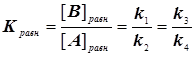 (4.9)
(4.9)
Пример 3.2. Рассмотрим кинетику циклического превращения вида:
Если уравнение скорости реакции включает сумму различных членов для прямой реакции, что указывает на возможность нескольких путей её протекания, то принцип детального равновесия требует, чтобы каждый член в выражении для скорости прямой реакции был скомпенсирован при равновесии соответствующим членом в выражении для скорости обратной реакции.
4) Мономолекулярные реакции. Схема Линдемана.
Существование мономолекулярных реакций типа реакций разложения в газах необычно с точки зрения бимолекулярного механизма накопления энергии активации. Наблюдаемый порядок первый, а стадия активации не может быть иной, как бимолекулярной. В чём же дело? В качестве варианта объяснения этой ситуации Линдеман предложил такие процессы рассматривать как сложные, включая в них следующие стадии:
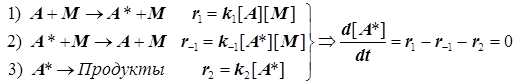 (4.9)
(4.9)
Отсюда следует простой результат.
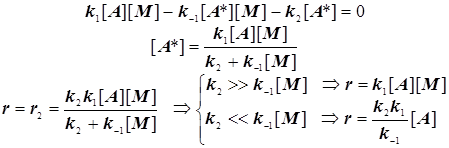 (4.10)
(4.10)
Экспериментальные данные часто не вполне соответствуют простой формально-кинетической схеме Линдемана, однако теоретические уточнения позволяют достичь приемлемого количественного и качественного согласия наблюдаемых фактов с этим механизмом. Всё же в основном идея балансирования между стадиями активации, дезактивации и самого превращения оказывается верна.
Пример 4.1 , илюстрирующий схему Линдемана: Реакция разложения диметилового эфира ![]()
5) О роли газокинетических моделей, из которых вытекают основные воззрения химической кинетики и о доводах в её пользу. (Забегаем немного вперед в части представлений об активации химического процесса).
Пример 5.1) Реакция разложения дийодэтана C2H4J2 = C2H4+J2 описывается единым уравнением Аррениуса и в газовой фазе, и в растворе в CCl4. Этот случай наиболее прямое свидетельство в пользу единой кинетической модели реакции в газе и в жидкости. Распределение Максвелла-Больцмана оказывается в растворе ещё устойчивее, чем в газе, и теория активных соударений оказывается весьма удачной. Причина этого состоит в особенно эффективном механизме перераспределения энергии при соударениях частиц в жидкой фазе. График температурной зависимости константы скорости этой реакции качественно выглядит примерно следующим образом.
|
|
|
|
|
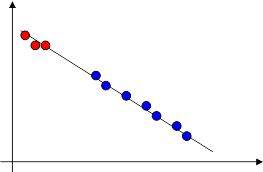
Рис. 9. Пример единой аррениусовской зависимости в газовой и жидкой фазах.
