Формально–кинетический анализ гипотез
и новые итоговые уравнения:
I) H2 + C2H4 = C2H6
II*) 0 = 0
Второй маршрут (II*) называют пустым маршрутом. Скорость реакции по пустому маршруту не равна нулю. Это скорость перехода интермедиатов:
![]()
по циклической последовательности стадий. Скорости ![]() ,
, ![]() ,
, ![]() по пустому маршруту равны нулям.
по пустому маршруту равны нулям. ![]() ,
, ![]() ,
, ![]() .
.
Ранг матрицы BP, т.е. базис QP итоговых уравнений, для маршрутов I и II равен 1 (QP = rankBP = 1). Во втором случае (I и II*) число ненулевых итоговых уравнений равно QP. Такой базис маршрутов называется “стехиометрическим базисом” маршрутов (число пустых маршрутов равно P – QP).
На данном множестве реагентов и продуктов мы имеем максимальный базис итоговых (брутто) реакций по стехиометрическому правилу Гиббса
![]() , (22)
, (22)
где N – общее число участников, Н – атомная матрица. Сравнение Qmax с базисом итоговых уравнений маршрутов QP дает неравенство:
Qmax ≥ QP, (23)
при этом, QP ≤ P, Qmax ≥ P.
В рассмотренном выше примере №1 Qmax = 1, QP = 1, Р = 2.
Пример 4. Рассмотрим более сложный случай пятистадийного цепного процесса пиролиза этана.
(1) ![]()
(2) ![]()
(3) ![]()
(4) ![]()
(5) ![]()
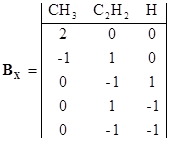
rankBX = 3 P = S – NI = 5 – 3 = 2
Произведение ![]() дает три уравнения:
дает три уравнения:
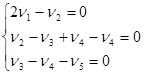
Возьмем n4 и n5 в качестве независимых переменных и преобразуем систему уравнений:
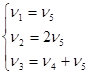
Определитель левой части D ¹ 0. Задавая n4 = 1, n5 = 0 и n4 = 0, n5 = 1, получаем матрицу Г для Р = 2 и матрицу BP:
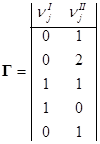
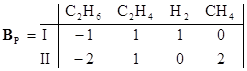
I) C2H6 = C2H4 + H2 QP = rankBP = 2
II) 2C2H6 = C2H4 + 2CH4 Qmax = 2
Приближения квазистационарности и квазиравновесия
При выводе кинетических уравнений часто используют различные допущения о соотношениях скоростей стадий, поскольку скорости элементарных стадий могут сильно различаться по величине. Например, скорости стадий адсорбции и химических превращений на поверхности катализатора. Важное допущение – о наличии медленных и быстрых стадий. Быстрые обратимые стадии являются квазиравновесными (РЕ – preequilibrium), а допущение о наличии таких стадий – приближением квазиравновесия. В закрытых системах особенно для каталитических реакций используют допущение о квазистационарности концентраций интермедиатов (SS – steady - state, допущение Боденштейна). Критерии применимости этих допущений рассмотрены в учебном пособии О.Н. Тёмкина, К.Ю. Одинцова и Л.Г. Брука “Приближения квазистационарности и квазиравновесия в химической кинетике”, М., МИТХТ, 2001г. Здесь приведем условия реализации различных приближений для простой схемы:
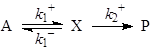 (24)
(24)
Необходимым и достаточным условием реализации приближения Боденштейна (SS) является условие СХ << СА (ΣСXi << CA). Из этого условия следует и условие
![]() (25)
(25)
которое реализуется при ![]() Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE).
Условие SS может одновременно совпадать с условием квазиравновесия первой стадии (PE).
Для одномаршрутных механизмов единственную медленную стадию (все остальные квазиравновесные) называют лимитирующей стадией. Критерием условия квазиравновесия для механизма (24) является соотношение (26)
![]() (26)
(26)
Из анализа соотношений констант k1, k-1 и k2, приводящих к ε1<<1 и ε2<<1, сделан вывод, что при значительном различии ki (не менее, чем в 10 раз) имеется всего 6 вариантов соотношений констант и по 4 случая реализации режимов SS (ε1<<1) и РЕ (ε2<<1).
Таблица 1. Соотношения констант скорости и режимы протекания процесса (24).
|
№ варианта |
Соотношения ki |
|
|
Режим |
Лимитирующая стадия |
|
I |
k2>>k1>>k-1 |
<<1 |
>>1 |
SS |
1 |
|
II |
k2>>k-1>>k1 |
<<1 |
>>1 |
SS |
1 |
|
III |
k1>>k2>>k-1 |
>>1 |
<<1 |
PE * |
2 |
|
IV |
k1>>k-1>>k2 |
>>1 |
<<1 |
PE |
2 |
|
V |
k-1>>k2>>k1 |
<<1 |
<<1 |
SS, PE |
2 |
|
VI |
k-1>>k1>>k2 |
<<1 |
<<1 |
SS, PE |
2 |
Как мы видим, сильными условиями режима SS являются условия k2>>k1, k-1 (I, II) и k-1>>k1 (V, VI), делающие ε1<<1, в первом случае за счёт быстрого превращения Х, а во втором – за счёт очень маленькой К1 = k1/ k-1.
Вариант III является режимом PE*( ε2<<1), но при большой разнице констант. При десятикратном различии констант режим РЕ устанавливается позднее, чем в других случаях (при большом значении выхода продукта Р), по существу на завершающем этапе процесса.
