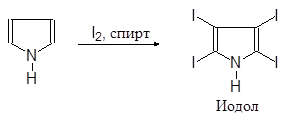Фуран. Тиофен. Пиррол
2.1. Получение
В промышленности тиофен производят по реакции ацетилена с сероводородом при 400оС или из н-бутана и серы в газовой фазе:
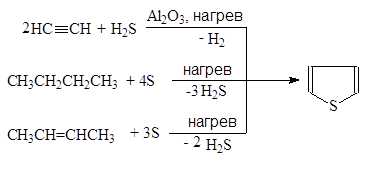 |
(37)
2.2. Свойства
Тиофен, в отличие от фурана и пиррола, не дает с обычными кислотами тиониевых солей и, следовательно, в кислой среде не утрачивает ароматических свойств. Он не обладает ацидофобностью.
Тиофен легко вступает в характерные для ароматических соединений реакции электрофильного замещения. Механизм этих реакций аналогичен механизму соответствующих реакций фурана:
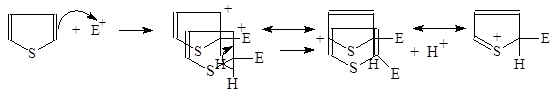 |
(М 4)
Поскольку тиофен, в отличие от фурана, не чувствителен к воздействию кислот, эти реакции могут осуществляться в присутствии протонодонорных реагентов. Нужно иметь в виду, что атом серы может быть окислен азотной кислотой. Поэтому тиофен нельзя нитровать азотной кислотой, а только ацетилнитратом.
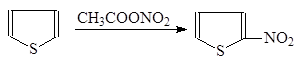 (38)
(38)
Тиофен a-Нитротиофен
Тиофен легко на холоде сульфируется концентрированной серной кислотой c образованием тиофен-2-сульфокислоты:
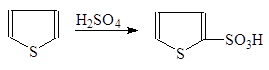
(39)
a-Тиофенсульфокислота
Поскольку бензол в аналогичных условиях не сульфируется, эта реакция используется для очистки бензола от тиофена.
В отличие от фурана тиофен замещает на хлор и бром лишь два атома. С иодм в присутствии оксида ртути замещается только один атом водорода.
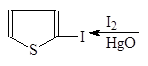
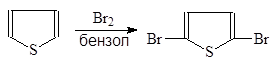
(40)
2,5-Дибромтиофен
При бромировании тиофена N-бромсукцинимидом образуется 2-бромтиофен:
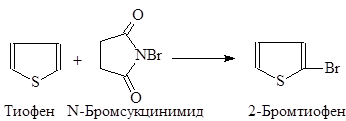 (41)
(41)
Реакцию Фриделя-Крафтса в случае тиофена приходится осуществлять не с AlCl3, а с более мягко действующими SnCl4 или SiCl4. Возможно также ацилирование тиофена:
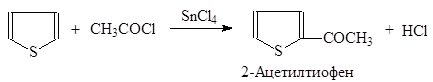 |
(42)
Тиофен почти совсем не обнаруживает ненасыщенного характера и не полимеризуется под действием кислот. Гидрирование тиофена в присутствии палладиевого катализатора приводит к образованию тиофана, в присутствии же никелевого катализатора гидрирование сопровождается десульфурированием:
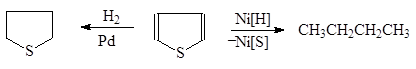 |
(43)
Тиофан
Тиолан может быть окислен в сульфоноксид (сульфан) или в тиоландиоксид (сульфолан)
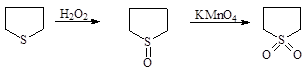 |
Упр.12. Промышленный синтез тиофена осуществляется пропусканием (1 сек) через раскаленную трубку при температуре 600оС смеси серы с бутаном, бутадиеном или бутенами. Напишите соответствующие реакции.
Упр.13. Напишите следующие реакции тиофена: (а) сульфирования (серной кислотой и хлорсульфоновой кислотой), (б) нитрования (ацетилнитратом), (в) ацилирования (фталевым ангидридом), (г) хлорирования (хлористым сульфурилом), (д) бромирования (бромом). Опишите механизм этих реакций.
3. ПИРРОЛ
Пиррольное кольцо входит в структуру многих важных природных соединений, таких как гемин, хлорофил и др.
3.1. Получение
Пиррол содержится в каменноугольной смоле и костном масле. В лаборатории его можно получать сухой перегонкой аммонийной соли слизевой кислоты или перегонкой сукцинимида с цинковой пылью:
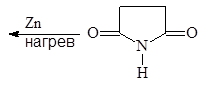
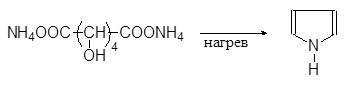
(46, 47)
Пиррол может быть получен действием аммиака на фуран в присутствии оксида алюминия (рнакция Юрьева):
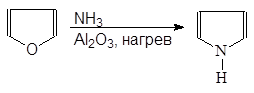 |
(48)
3.2. Свойства
Пиррол представляет собой бесцветную темнеющую на воздухе жидкость с т. кип. 131оС. Характерной для соединений ряда пиррола является их способность окрашивать в красный цвет смоченную в соляной кислоте сосновую лучину. Отсюда и название “пиррол” [“красное масло”].
3.2.1. Кислотно-основные свойства
Пиррол, как и фуран, проявляет ацидофобные свойства. При действии кислот он протонируется и полимеризуется.Пиррол является слабым основанием и одновременно очень слабой кислотой, более слабой, чем фенол. Он реагирует с КОН при сплавлении:
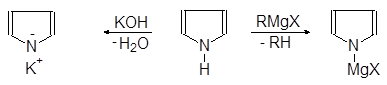 |
(49)
Пирролкалий Пиррол Пирролмагнийгалогенид
Пирролкалий реагирует с диоксидом углерода с образованием калиевой соли
пиррол-2-карбоновой кислоты:
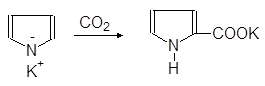 (50)
(50)
Пирролкалий Пиррол-2-карбонат калия
Пирролмагнийбромид реагирует с алкилгалогенидами образуя 2- и
3-алкилпирролы:
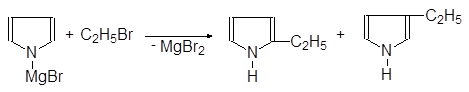 |
(51)
Пирролмагнийбромид a-Этилпиррол b-Этилпиррол
3.2.2. Реакции электрофильного замещения
Пиррол очень реакционноспособен по отношению к электрофильным реагентам. Механизм этих реакций аналогичен механизму соответствующих реакций фурана:
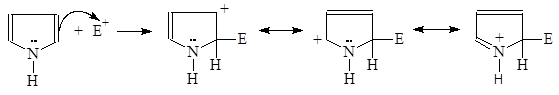 (М 4)
(М 4)
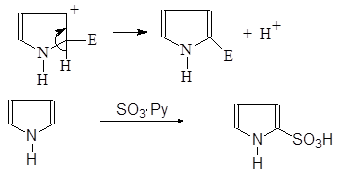
(52)
Пиррол a-Пирролсульфокислота
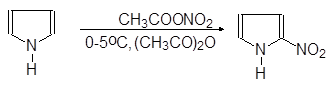 |
(53)
a-Нитропиррол