Химический эксперимент по неорганической химии в системе проблемного обучения
Учащиеся:
Na+ + OH– → NaOH;
Na+ + Cl– → NaСl;
Al3++ 3Cl– → AlСl3;
Al3++ 3OH– → Al(OH)3↓ .
Таким образом, все вещества находятся в одной пробирке, следовательно, вступать во взаимодействие могут не только исходные вещества, но и продукты их взаимодействия.
Учитель: запишем оба уравнения и суммируем их:
2Na + 2 H2O → 2 NaOH + H2↑
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
Суммарно: Na + AlCl3 + H2O → Al(OH)3↓ + NaCl + H2↑
Расставим коэффициенты методом электронного баланса:
Na0 + AlCl3 + H+2O → Al(OH)3↓ + Na+Cl + H20 ↑
Na0 – е– → Na+ 2
2 H+ + 2 е– → H20 1
2Na0 + AlCl3 + H+2O → Al(OH)3↓ + 2Na+Cl + H20 ↑
Занятие № 5. Тема: Металлы
Приведённые ниже опыты проводятся в 9 классе при изучении темы «Металлы» на уроке № 23 «Генетические ряды Fe2+ и Fe3+» (см. тематическое планирование 9 класс).
Цель работы: изучить свойства солей железа (III), как окислителей
Форма работы: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: кристаллический хлорид аммония и хлорид железа (Ш), колба Вюрца, известковая вода, лучинка, склянки Дрекселя, спиртовка, индикаторная бумага.
Опыт 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Хлорид Fe (III) проявляет окислительные свойства по отношению к различным восстановителям. В беседе предшествующей проведению опыта, перед учащимися ставим вопрос: возможно ли химическое взаимодействие между двумя кристаллическими солями хлоридом железа трехвалентного и хлоридом аммония? В поиске ответа на данный вопрос ученики обращаются к таблице растворимости, так как, им известно, что соли взаимодействуют между собой при условии, что они хорошо растворимы, а в результате реакции обмена получается новая нерастворимая соль. В процессе беседы учитель поясняет, что таблицу растворимости в данном случае, при использовании кристаллических вещест, применять нельзя. Таким образом, предварительное обсуждение приводит учащихся к выводу о невозможности химического взаимодействия между указанными веществами.
Далее проводим эксперимент. Он представляет интерес не только для выяснения окислительных свойств хлорида железа (III), но и как способ получения азота в лабораторных условиях.
Ход опыта:
В соответствии с стехиометрическими коэффициентами в уравнении реакции: 6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2, учитель готовит смесь кристаллических солей хлорида железа (III) и хлорида аммония. Эту смесь помещают в колбу Вюрца, которую соединяют с двумя склянками Дрекселя, заполненными водой (рис. 1). Промывные склянки необходимы для того, чтобы поглотить выделяющийся в ходе реакции хлороводород. Соблюдая технику безопасности, проводят нагревание. Образовавшийся азот можно собрать в 2-3 пробирки над водой.
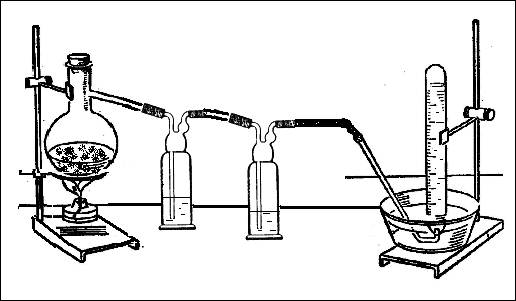
Рис. 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Далее проверяем отсутствие примеси хлороводорода, поднеся влажную индикаторную бумагу к отверстию пробирки с азотом. Она не изменяет цвет. Проводим опыт подтверждающий, что собранный газ действительно азот.
а) В первую пробирку с азотом опускаем горящую лучинку она гаснет, не оставляя даже раскаленного уголька.
б) Во вторую – наливаем известковую воду, в отличие от углекислого газа, известковая вода от азота не мутнеет.
Доказав учащимся, что получен азот, отвергаем их мнение о невозможности взаимодействия хлорида железа (III) с хлоридом аммония.
Создается проблемная ситуация. Далее ученики должны выдвинуть свои предположения о роли каждого вещества в данной химической реакции. Анализ состава исходных веществ и результатов опыта приводит к выводу, что хлорид железа (III) выступает в роли окислителя, а соль аммония, имея в своем составе атомы азота в низшей степени окисления (– 3), проявляет восстановительные свойства. Подтверждаем этот вывод и напоминаем учащимся другие примеры проявления данными веществами указанных свойств. Затем предлагаем учащимся самостоятельную работу по составлению уравнения окислительно-восстановительной реакции между хлоридом железа (III) и хлоридом аммония. При составлении уравнения реакции учащиеся должны учесть, что один из продуктов реакции – хлороводород.
6FeCl3 + 2NH4Cl = 6FeCl2 + 8HCl + N2
Fe3+ + e- ® Fe2+ | 6
2N3- - 6e- ® N20 | 1
Опыт2. Взаимодействие роданида железа (III) с фосфорной кислотой
Этот опыт очень эффектен и может быть использован в процессе эвристической беседы не только при изучении темы «Металлы», но и при рассмотрении качеств реакции на фосфат-ионы. В аналитической химии известна реакция взаимодействия растворимых солей железа (III) с фосфат-ионами, сопровождающаяся образованием желтовато-белого осадка фосфата железа трехвалентного. Этот опыт рекомендуем провести на уроке, как пример качественной реакции на фосфат-ионы и с целью подготовки учащихся к обсуждению проблемного эксперимента.
Учитель: будет ли роданид железа (III) взаимодействовать с фосфорной кислотой?
Ученики: такая реакция невозможна, поскольку эта соль железа – малодиссоциированное соединение, и ионы железа (III), необходимые для образования осадка фосфата железа (III), в растворе отсутствуют.
Реактивы и оборудование: раствор роданида железа (Ш), раствор фосфорной кислоты, пробирки.
Ход опыта:
Для проведения опыта получен роданид железа (III) путем взаимодействия растворимой соли железа (III) с роданидом калия или аммония. Этому процессу соответствует краткое ионное уравнение реакции.
Fe3+ + 3SCN- = Fe(SCN)3
К винно-красному раствору роданида железа (III) приливаем фосфорную кислоту. Протекает эффектная реакция, сопровождающаяся обесцвечиванием реакционной смеси с одновременным образованием желтовато-белого осадка фосфата железа (III).
Результаты опыта вызывают проблемную ситуацию.
Учитель: роданид железа (III), как и любое малодиссоциирующее соединение, очень плохо, но подвергается диссоциации.
Ученики:
Fe(SCN)3 <=> Fe3+ + 3SCN-
Учитель: Диссоциация процесс обратимый, следовательно, его равновесие можно сместить, добавив в раствор вещество, способное связывать ионы в соединение с меньшей степенью диссоциации. В данном случае происходит разрушение комплексного соединения роданида железа (III) вследствие образования осадка фосфата железа (III).
Fe(SCN)3 + PO43- = FePO4 + 3SCN-
Занятие № 6. Тема: «Гидролиз солей»
Предложенные ниже опыты рекомендуется проводить при изучении темы «Строение вещества и их свойства» у учащихся 11 классов, обучающихся по учебнику О. С. Габриеляна «Химия-11» на уроке по теме «Гидролиз неорганических веществ» (см. тематическое планирование 10 класс)
Цель работы: получить представления о гидролизе неорганических веществ, используя проблемный эксперимент.
