Химия белка
Для белков также используется понятие КОНФОРМАЦИЯ белковой молекулы - определенное, но не застывшее, не неизменное взаимное расположение частей молекулы. Так как конформация белковой молекулы формируется при участии слабых типов связей, то она является подвижной (способной к изменениям), и белок может изменять свою структуру. В зависимости от условий внешней среды молекула может существовать в разных конформационных состояниях, которые легко переходят друг в друга. Энергетически выгодными для реальных условий являются только одно или несколько конформационных состояний, между которыми существует равновесие. Переходы из одного конформационного состояния в другое обеспечивают функционирование белковой молекулы. Это обратимые конформационные изменения (встречаются в организме, например, при проведении нервного импульса, при переносе кислорода гемоглобином). При изменении конформации часть слабых связей разрушается, и образуются новые связи слабого типа.
ЛИГАНДЫ
Взаимодействие белка с каким-нибудь веществом иногда приводит к связыванию молекулы этого вещества молекулой белка. Этот явление известно как «сорбция» (связывание). Обратный же процесс - освобождение другой молекулы от белковой называется «десорбция».
Если для какой-нибудь пары молекул процесс сорбции преобладает над десорбцией, то это уже специфическая сорбция, а вещество, которое сорбируется, называется «лиганд».
Виды лигандов:
1) Лиганд белка-фермента – субстрат.
2) Лиганд траспортного белка – транспортируемое вещество.
3) Лиганд антитела (иммуноглобулина) – антиген.
4) Лиганд рецептора гормона или нейромедиатора – гормон или нейромедиатор.
Белок может изменять свою конформацию не только при взаимодействии с лигандом, но и в результате любого химического взаимодействия. Примером такого взаимодействия может служить присоединение остатка фосфорной кислоты.
В природных условиях белки имеют несколько термодинамически выгодных конформационных состояний. Это нативные состояния (природные). Natura (лат.) – природа.
НАТИВНОСТЬ БЕЛКОВОЙ МОЛЕКУЛЫ
НАТИВНОСТЬ - это уникальный комплекс физических, физико-химических, химических и биологических свойств белковой молекулы, который принадлежит ей, когда молекула белка находится в естественном, природном (нативном) состоянии.
Например: белок хрусталика глаза - кристаллин - обладает высокой прозрачностью только в нативном состоянии).
ДЕНАТУРАЦИЯ БЕЛКА
Для обозначения процесса, при котором нативные свойства белка теряются, используют термин ДЕНАТУРАЦИЯ.
ДЕНАТУРАЦИЯ - это лишение белка его природных, нативных свойств, сопровождающееся разрушением четвертичной (если она была), третичной, а иногда и вторичной структуры белковой молекулы, которое возникает при разрушении дисульфидных и слабых типов связей, участвующих в образовании этих структур. Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ БЕЛКОВ
Факторы, которые вызывают денатурацию белков, можно разделить на физические и химические.
Физические факторы
1. Высокие температуры. Для разных белков характерна различная чувствительность к тепловому воздействию. Часть белков подвергается денатурации уже при 40-500С. Такие белки называют термолабильными. Другие белки денатурируют при гораздо более высоких температурах, они являются термостабильными.
2. Ультрафиолетовое облучение
3. Рентгеновское и радиоактивное облучение
4. Ультразвук
5. Механическое воздействие (например, вибрация).
Химические факторы
1. Концентрированные кислоты и щелочи. Например, трихлоруксусная кислота (органическая), азотная кислота (неорганическая).
2. Соли тяжелых металлов (например, CuSO4).
3. Органические растворители (этиловый спирт, ацетон)
4. Растительные алкалоиды.
5. Мочевина в высоких концентрациях
5. Другие вещества, способные нарушать слабые типы связей в молекулах белков.
Воздействие факторами денатурации применяют для стерилизации оборудования и инструментов, а также как антисептики.
Обратимость денатурации
В пробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
In vivo, в организме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации. Такие специфические белки известны как «белки теплового шока» или «белки стресса».
Белки стресса
Существует несколько семейств этих белков, они отличаются по молекулярной массе.
Например, известен белок hsp 70 – heatshock protein массой 70 kDa.
Такие белки есть во всех клетках организма. Они выполняют также функцию траспорта полипептидных цепей через биологические мембраны и участвуют в формировании третичной и четвертичной структур белковых молекул. Перечисленные функции белков стресса называются шаперонными. При различных видах стресса происходит индукция синтеза таких белков: при перегреве организма (40-440С), при вирусных заболеваниях, отравлениях солями тяжелых металлов, этанолом и др.
В организме южных народов установлено повышенное содержание белков стресса, по сравнению с северной расой.
Молекула белка теплового шока состоит из двух компактных глобул, соединенных свободной цепью:

Разные белки теплового шока имеют общий план построения. Все они содержат контактные домены.
Разные белки с различными функциями могут содержать одинаковые домены. Например, различные кальций-связывающие белки имеют одинаковый для всех них домен, отвечающий за связывание Ca+2.
Роль доменной структуры заключается в том, что она предоставляет белку большие возможности для выполнения своей функции благодаря перемещениям одного домена по отношению к другому. Участки соединения двух доменов – самое слабое в структурном отношении место в молекуле таких белков. Именно здесь чаще всего происходит гидролиз связей, и белок разрушается.
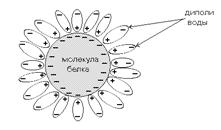
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. РАСТВОРИМОСТЬ БЕЛКОВ В ВОДЕ
Большинство белков гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому белки не могут образовывать истинных растворов, а только коллоидные. Внешнее проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля вызывается рассеянием тонкого пучка света при прохождении через белковый раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в водных растворах. Осаждению белковых молекул препятствуют факторы стабилизации белкового раствора.
