Химия и технология платиновых металлов
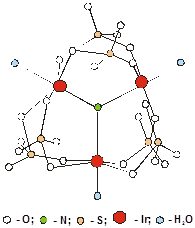
Рис. 1. Структура комплекса [Ir3(m3-N) (SO4)6(H2O)3]4-
Первое рентгеноструктурное исследование сульфатного комплекса платинового металла, выполненное в 1971 г., показало, что соединение K4[(Ir3(m3-N) (m-SO4)6(H2O)3] имеет трехъядерное строение [28]. Центральный атом азота, лежащий на тройной оси, координируется с тремя атомами иридия, сохраняющими октаэдрическую точечную симметрию и соединенными попарно двумя сульфатогруппами. Структура комплекса изображена на рис. 1. Октаэдрическая координация вокруг атома иридия дополнена молекулами воды в транс-положении к атому азота. Расположение атомов азота, иридия и молекул воды – фактически плоскостное (максимальное отклонение 0.01Å).
Структура однотипного оксосульфата неизвестна. Можно говорить лишь о том, что оно аналогично выше приведенному.
Оксосульфатокомплекс Ir (III, III, IV) в водных растворах серной кислоты подвергается ступенчатому гидролизу, первая стадия которого протекает медленно, без разрушения трехъядерной структуры комплексного аниона [Ir3III,III,IVO(SO4)9]10- и сопровождается замещением концевых сульфатогрупп молекулами воды:
[Ir3III,III,IVO(SO4)9]10- + 3H2O ![]() (Ir3III,III,IVO) (SO4)6(H2O)3]4- + 3SO42-
(Ir3III,III,IVO) (SO4)6(H2O)3]4- + 3SO42-
3.3 Амминокомплексы платиновых металлов
В состав амминокомплексов входит в качестве лиганда молекула аммиака. Амминокомплексы образуются в процесах аффинажа, например, плоскоквдратный комплекс состава [Pd(NH3)2Cl2]. Комплекс транс-строения характеризуются крайне низкой растворимостью в воде, благодаря чему используется для количественного выделения палладия из растворов аффинажного производства (см. раздел 5).
3.4 Нитрокомплексы платиновых металлов
Образуются при нитровании путем замещения лигандов во внутренней сфере комплексов на ион NO2- В нитрокомплексах платиновые металлы проявляют более низкие характерные для них степени окисления. Известны следующие комплексы: [M(NO2)4]2-, где M = Pd(II), Pt(II); [M¢(NO2)6]3-, где M¢ = Rh(III), Ir(III); [M¢¢NO(NO2)4OH]2-, где M¢¢ = Ru, Os. Различие в составе и свойствах указанных соединений обусловливает возможность разделения близких по свойствам платиновых металлов. Они хорошо растворимы в водных растворах и не гидролизуются. Подробно поведение нитрокомплексов рассмотрено ниже.
4. Технологические аспекты аффинажа платиновых металлов
4.1 «Классическая» технология
Аффинаж (от французского «affiner» – очищать) – заключительная стадия переработки различных видов платиносодержащего сырья. Конечными продуктами аффинажа являются платиновые металлы в виде порошков и слитков, которые по чистоте должны отвечать требованиям ГОСТ.
На аффинаж поступают первичное сырье (концентраты, образующиеся при переработке шламов, «шлиховая платина») и вторичное сырье (электронный лом, дезактивированные катализаторы, отработанные электролиты и др.). Выбор конкретной технологической схемы и оптимальных режимов технологических операций зависит от количественного и качественного состава продуктов, подлежащих переработке. Чтобы добиться максимального извлечения ценных металлов с минимальными потерями, а также с целью сокращения незавершенного производства, необходимо рационально сочетать в технологическом цикле известные методы и приемы, которые будут изложены ниже. Варианты технологических схем переработки некоторых видов сырья даны в Приложении.
Первоначально на примере «шлиховой платины» рассмотрим аффинаж по классической схеме, предусматривающей выделение платиновых металлов в виде трудно растворимых комплексных соединений с последующим их прокаливанием и получением аффинированных порошков. Следует подчеркнуть, что в настоящее время практически повсеместно и в нашей стране, и за рубежом для вскрытия платиносодержащего сырья используется процесс гидрохлорирования, в результате которого все металлы платиновой группы, а также золото переходят в раствор в виде комплексных хлоридов (серебро остается в твердом остатке). Важно здесь обратить внимание на поведение осмия в процессе гидрохлорирования. Установлено, что в растворах гидрохлорирования металлического осмия и осмийсодержащих продуктов (температура процесса 80 оС, расход хлора – 1 л/час, СHCl = 0.5 – 6 М) присутствует Os(VIII) в виде OsO4. С ростом концентрации HCl в растворе, содержащем OsO4, его переход в газовую фазу растет. Отсюда вытекает принципиальный вывод о необходимости улавливания тетраоксида осмия на стадии вскрытия сырья во избежание потерь этого весьма редкого и дорогого платинового металла. Аналогичным образом ведет себя осмий и при «царсководочном» вскрытии. Растворение «шлиховой платины» в «царской водке» – традиционный, хотя и несколько устаревший метод растворения продуктов, содержащих платину. Остановимся подробнее на поведении платиновых металлов при растворении «шлиховой платины» и их последующем разделении и выделении.
4.1.1 Аффинаж платины
Растворение «шлиховой платины» в «царской водке» осуществляется при температуре 70–85 оС, причем сырье загружается в предварительно нагретую до указанной температуры соляную кислоту, а затем добавляется рассчитанное количество HNO3. Внешними признаками конца растворения является бурное вспенивание и выделение паров оксидов азота по реакциям:
3HCl + HNO3 = NOCl + Cl2 + 2H2O
NOCl ® NO + Cl
2NO + O2 ® NO2.
Таким образом, не исключено выделение весьма реакционноспособного атомарного хлора, взаимодействующего с благородными и неблагородными металлами. Последние переходят в хлориды (FeCl3, CuCl2 и др.), а платина, палладий и золото – в хлоридные комплексы в соответствии с реакциями:
3Pt + 18HCl + 4HNO3 = 3H2[PtCl6] + 4NO + 8H2O
3Pd + 18HCl + 4HNO3 = 3H2[PdCl6] + 4NO2 + 8H2O
Au + 4HCl + HNO3 = H[AuCl4] + NO + 2H2O.
Палладий даже при растворении в «царской водке» частично переходит в тетрахлоропалладиевую кислоту H2[PdCl4], где проявляет типичную для него степень окисления +2. Некоторое количество платины и иридия образуют соединения H2[PtCl4] и H2[IrCl6], соответственно. Небольшая часть платины может образовывать гексахлороплатинат(IV) железа по реакции:
3H2[PtCl6] + 2FeCl3 = Fe2[PtCl6]3 + 6HCl.
В присутствии азотной кислоты также образуются нитрозохлоридные соединения платиновых металлов, которые выпадают в виде желтого осадка. Образование нитрозохлоридных соединений протекает по реакциям:
H2[PdCl4] + 2NOCl = (NO)2[PdCl4] + 2HCl
H2[PtCl6] + 2NOCl = (NO)2[PtCl6] + 2HCl
H2[IrCl6] + 2NOCl = (NO)2[IrCl6] + 2HCl
Если нитрозохлоридные соединения не разрушать, то они будут оставаться в нерастворимом остатке. Разрушение их осуществляется нагреванием раствора с добавлением воды при температуре 105–110 оС в результате протекания следующих реакций:
(NO)2[PtCl6] + H2О = H2[PtCl6] + NO+ NO2.
Аналогично идут реакции для палладия и иридия. Конец разрушения определяется по прекращению выделения бурых паров оксидов азота и вскипания.
