Химия лантаноидов
ПРОМЕТИЙ.
Прометий - один из 4 искусственных не трансурановых элементов. В природе он образуется в результате радиоактивного распада ядер тяжелых элементов. Обнаружить прометий в земной коре удалось только после того, как он был получен искусственным путем.
Элемент N61 был открыт в 1947 году американскими исследователями Маринским, Гленденином и Кориелом среди продуктов, образующихся в ядерном реакторе.
Сейчас известно 14 изотопов прометия. Все они радиоактивны. Самый долгоживущий из них - прометий-145 с периодом полураспада около 18 лет. Практически наиболее важен прометий-147 (период полураспада 2,64 года), который используют в миниатюрных атомных батареях, способных давать электроэнергию в течение нескольких лет. Такие батарей можно использовать как источник тока на космических кораблях, управляемых снарядах, радиоустройствах, часах и даже слуховых аппаратах.
В прометиевой атомной батарее происходит двукратное преобразование энергии. Сначала излучение прометия заставляет светиться специальный люминесцирующий состав, а световая энергия преобразуется в электрическую в кремниевом фотоэлементе. На одну батарейку используется всего 5 мг окиси прометия-147. Особенность прометия-147 в том, что он не испускает гамма-лучей, а дает лишь мягкое бета-излучение, задерживаемое даже тонким слоем люминисцента и корпусом батареи.
САМАРИЙ.
В середине XIX века на Урале был найден черный блестящий минерал, позднее названный самарскитом. В книге Н.А. Фигуровского "Открытия элементов и происхождение их названий" указано, что этот минерал открыт русским горным инженером В.Е.Самарским.
В 1878 году французский химик Делофонтен работал с самарскитом и выделил из него окись дидима. В спектре дидима, полученного из самарскита, Делафонтен обнаружил две новые голубые линии. Решив, что они принадлежат новому элементу, он сразу же дал этому элементу название: деципий - от латинского decipere, "обманывать, одурачивать". Однако позже было доказано, что деципий являлся смесью самария с другими редкоземельными элементами, прежде всего с неодимом и празеодимом.
Вскоре появились и другие сообщения о необычных спектральных линиях в окиси дидима. Окончательно подтвердил неоднородность этого вещества другой французский химик - Лекок де Буабодран. Он, как и Делафонтен, нашел две новые голубые линии (с длинами волн 400 и 417 Å), но эти линии отличались от линий деципия. В 1879 году Лекок де Буабодран назвал новый элемент самарием.
Через год швейцарский химик Ж. Ш. Мариньяк нашел в самарските еще один новый элемент. Он получил из самарскита две фракции, одна из которых давала точно такой же спектр, как у элемента, открытого Буабодраном. Так было подтверждено открытие самария.
Элементарный самарий был получен в начале ХХ века, но еще несколько десятилетий не находил применения. Сегодня элемент (и его соединения) довольно важен для атомной энергетики: самарию свойственно большое поперечное сечение захвата тепловых нейтронов - около 6500 барн[2]. Это больше, чем у бора и кадмия - традиционных материалов регулирующих стержней. Керамические материалы, в которые входят окись самария (порошок бледно-кремового цвета), стали использовать в качестве защитных материалов в реакторостроении.
В последние годы особое внимание ученых и практиков привлекло интерметаллическое соединение самария с кобальтом SmCo5, применяемое для изготовления сильных постоянных магнитов.
Дииодид самария – сильный восстановитель, растворяющийся в органических растворителях и ведущий себя в условиях органического синтеза как донор электронов и поэтому способен промотировать реакции, протекающие путем переноса электрона (рис. 3.1).
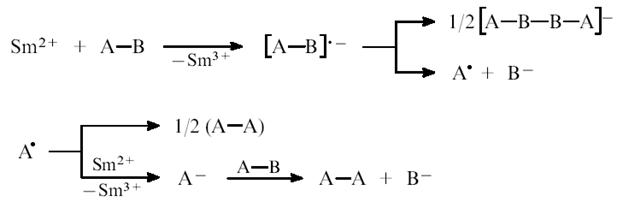
Механизм органических реакций с участием SmI2 (общий вид)
Рис 3.1
Использование SmI2 способствует протеканию многих органических реакций с высокими скоростями и высоким выходом конечного продукта даже при низких температурах (-70 - 20°С), а так же позволяет провести реакции, которые не удавалось провести с помощью других восстановителей (йодметилирование карбонильных соединений, синтез больших лактонных циклов, селективное восстановление альдегидной группы в присутствии кетонной).
Кроме того, самарий вводят в состав стекол, способных люминесцировать и поглощать инфракрасные лучи.
Но не всегда самарий полезен. Физики считают, что из радиоактивных изотопов наибольшую опасность в качестве «реакторного яда» представляет ксенон-135, а из стабильных - изотоп самария с массовым числом 149. Сечение захвата тепловых нейтронов у самария-149 огромно - 66000 барн. Но в работающем реакторе происходит как бы самоочищение: при поглощении нейтрона самарий-149 превращается в самарий-150, который поглощает замедленные нейтроны намного хуже:
14962Sm(n, γ)Sm62150
Для реактора на быстрых нейтронах самарий-149 не опасен: быстрые нейтроны его ядрами не захватываются.
Природный самарий состоит из семи изотопов (массовые числа: 144, 147, 148, 149, 150, 152 - самый распространенный изотоп - и 154). Самарий-147 α - радиоактивен, период его полураспада около 100 миллиардов лет.
Но не только из-за самария-147 радиоактивен минерал самарскит. В его состав наряду с редкими землями, кислородом, железом, танталом и ниобием входит уран.
ЕВРОПИЙ.
В 1886 году французский химик Демарсэ выделил из самариевой земли новый элемент, который, скорее всего, был не очень чистым европием. Но повторно опыт воспроизвести не удалось. В том же году англичанин Уильям Крукс обнаружил новую линию в спектре самарскита. Демарсе потратил на выделение нового элемента из самариевой земли несколько лет, и, наконец, в 1896 году ему удалось приготовить чистый препарат. Первоначально Демарсе обозначил открытый им элемент греческой заглавной буквой Σ (сигма). А в 1901 году после серии контрольных экспериментов этот элемент получил свое нынешнее название. Металлический европий впервые был получен лишь в 1937 году.
Европий - последний редкоземельный элемент подгруппы церия. Он самый легкий из лантаноидов, его плотность всего 5,245 г/см3. У европия же наибольшие из всех лантаноидов атомный радиус и атомный объем.
Так же, как и его соседи по таблице Менделеева, европий входит в число наиболее сильных поглотителей тепловых нейтронов. Отсюда его возможности в атомной технике и технике защиты от излучений. В качестве материала противонейтронной защиты элемент N63 интересен тем, что после поглощении нейтронов его природные изотопы 151Eu и 153Eu не теряют способность к дальнейшему поглощению нейтронов.
Радиоактивный европий, полученный из атомных реакторов, используется при лечении некоторых форм рака.
Важное значение приобрел европий как активатор люминофоров. Микропримесями европия активируют, в частности, окись иттрия Y2O3 и ортованадат иттрия YVO4, используемые для получения красного цвета на телевизионных экранах. Приобрели практическое значение и другие люминофоры, активированные европием.
