Химия наследственности. Нуклеиновые кислоты. ДНК. РНК. Репликация ДНК и передача наследственной информации
Величину отношения содержания суммы гуанина и цитозина к сумме содержания аденина и тимина, характеризующую нуклеотидный состав данного вида ДНК, принято называть коэффициентом специфичности. Каждая ДНК имеет характерный коэффициент специфичности, который может изменяться в пределах от 0,3 до 2,8. При подсчете коэффициента специфичности учитывается содержание минорных оснований, а также замены основных оснований их производными. Например, при подсчете коэффициента специфичности для ЭДНК зародышей пшеницы, в которой содержится 6% 5-метилцитозина, последний входит в сумму содержания гуанина (22,7%) и цитозина (16,8%). Смысл правил Чаргаффа для ДНК стал понятным после установления ее пространственной структуры.
4.2. Макромолекулярная структура ДНК
В 1953 г. Уотсон и Крик, опираясь на известные данные о конформаци нуклеозидных остатков, о характере межнуклеотидной связи в ДНК и закономерности нуклеотидного состава ДНК (правила Чаргаффа), расшифровали рентгенограммы паракристаллической формы ДНК [так называемой В-формы, образующейся при влажности выше 80% и при высокой концентрации противоионов (Li+) в образце]. Согласно их модели, молекула ДНК представляет собой правильную спираль, образованную двумя полидезоксирибонуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси. Диаметр спирали практически постоянен вдоль всей ее длины и равен 1,8 нм (18 А).
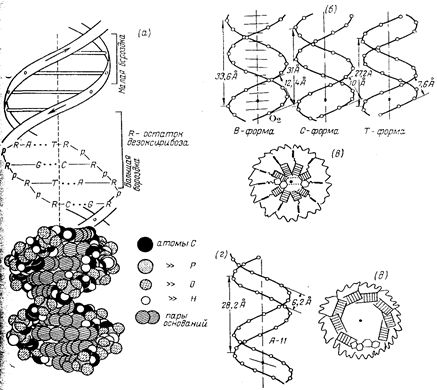
Макромолекулярная структура ДНК.
(а)—Модель Уотсона — Крика;
(6)—параметры спиралей В-, С- и Т-форм ДНК (проекции перпендикулярно оси спирали);
(в)—поперечный разрез спирали ДНК в В-форме (заштрихованные прямоугольники изображают пары оснований);
(г)—параметры спирали ДНК в А-форме;
(д)—поперечный разрез спирали ДНК в А-форме.
Длина витка спирали, который соответствует ее периоду идентичности, составляет 3,37 нм (33,7 А). На один виток спирали приходится 10 остатков оснований в одной цепи. Расстояние между плоскостями оснований равно, таким образом, примерно 0,34 нм (3,4 А). Плоскости остатков оснований перпендикулярны длинной оси спирали. Плоскости углеводных остатков несколько отклоняются от этой оси (первоначально Уотсон и .Крик предположили, что они параллельны ей).
Из рисунка видно, что углеводофосфатный остов молекулы обращен наружу. Спираль закручена таким образом, что на ее поверхности можно выделить две различные по размерам бороздки (их часто называют также желобками) — большую, шириной примерно 2,2 нм (22 А), и малую —шириной около 1,2 нм (12А). Спираль — правовращающая. Полидезоксирибонуклеотидные цепи в ней антипараллельны: это означает, что если мы будем двигаться вдоль длинной оси спирали от одного ее конца к другому, то в одной цепи мы будем проходить фосфодиэфирные связи в направлении 3'à5', а в другой — в направлении 5'à3'. Иными словами, на каждом из концов линейной молекулы ДНК расположены 5'-конец одной и 3'-конец другой цепи.
Регулярность спирали требует, чтобы против остатка пуринового основания в одной цепи находился остаток пиримидинового основания в другой цепи. Как уже подчеркивалось, это требование реализуется в виде принципа образования комплементарных пар оснований, т. е. остаткам аденина и гуанина в одной цепи соответствуют остатки тимина и цитозина в другой цепи (и наоборот).
Таким образом, последовательность нуклеотидов в одной цепи молекулы ДНК предопределяет нуклеотидную последовательность другой цепи.
Этот принцип является главным следствием модели Уотсона и Крика, поскольку он в удивительно простых химических терминах объясняет основное функциональное назначение ДНК — быть хранителем генетической информации.
Заканчивая рассмотрение модели Уотсона и Крика, остается добавить, что соседние пары остатков оснований в ДНК, находящейся в В-форме, повернуты друг относительно друга на 36° (угол между прямыми, соединяющими атомы С1' в соседних комплементарных парах).
4.3. Выделение дезоксирибонуклеиновых кислот
Живые клетки, за исключением сперматозоидов, в норме содержат значительно больше рибонуклеиновой, чем дезоксирибонуклеиновой кислоты. На методы выделения дезоксирибонуклеиновых кислот оказало большое влияние то обстоятельство, что, тогда как рибонуклеопротеиды и рибонуклеиновые кислоты растворимы в разбавленном (0,15 М) растворе хлористого натрия, дезоксирибонуклеопротеидные комплексы фактически в нем нерастворимы. Поэтому гомогенизированный орган или организм тщательно промывают разбавленным солевым раствором, из остатка с помощью крепкого солевого раствора экстрагируют дезоксирибонуклеиновую кислоту, которую осаждают затем добавлением этанола. С другой стороны, элюирование того же остатка водой дает раствор, из которого при добавлении соли выпадает дезоксирибонуклеопротеид. Расщепление нуклеопротеида, который в основном представляет собой солеподобный комплекс между полиосновными и поликислотными электролитами, легко достигается растворением в крепком солевом растворе или обработкой тиоцианатом калия. Большую часть белка можно удалить либо добавлением этанола, либо эмульгированием с помощью хлороформа и амилового спирта (белок образует с хлороформом гель). Широко применялась также обработка детергентами. Позднее дезоксирибонуклеиновые кислоты выделяли с помощью экстракции водными n-аминосалицилат — фенольными растворами. При использовании этого метода были получены препараты дезоксирибонуклеиновой кислоты, из которых одни содержали остаточный белок, тогда как другие были фактически свободны от белка, что указывает на то, что характер связи белок — нуклеиновая кислота различен в различных тканях. Удобная модификация состоит в гомогенизировании животной ткани в 0,15 М растворе фенолфталеиндифосфата с последующим добавлением фенола для осаждения ДНК (свободной от РНК) с хорошим выходом.
Дезоксирибонуклеиновые кислоты, каким бы способом они не выделялись, представляют собой смеси полимеров различного молекулярного веса, за исключением образцов, полученных из некоторых видов бактериофагов.
4.4. Фракционирование
Ранний метод разделения заключался в фракционной диссоциации гелей дезоксирибонуклеопротеида (например, нуклеогистона) посредством экстракции водными растворами хлористого натрия увеличивающейся молярности. Таким путем препараты дезоксирибонуклеиновой кислоты были разделены на ряд фракций, характеризующихся различным отношением содержания аденина с тимином к сумме гуанина с цитозином, причем более легко выделялись фракции, обогащенные гуанином и цитозином. Сходные результаты были получены при хроматографическом отделении дезоксирибонуклеиновой кислоты от гистона, адсорбированного на кизельгуре, с применением градиентного элюирования растворами хлористого натрия. В улучшенном варианте этого метода очищенные фракции гистона сочетались с n-аминобензилцеллюлозой с образованием диазомостиков от тирозиновых и гистидиновых групп белка. Описано также фракционирование нуклеиновых кислот на метилированном сывороточном альбумине (с кизельгуром в качестве носителя). Скорость элюирования с колонки солевыми растворами увеличивающейся концентрации зависит от молекулярного веса, состава (нуклеиновые кислоты с высоким содержанием гуанина с цитозином элюируются легче) и вторичной структуры (денатурированная ДНК прочнее удерживается колонкой, чем нативная). Таким способом из ДНК морского краба Cancer borealis выделен природный компонент — полидезоксиадениловая-тимидиловая кислота. Фракционирование дезоксирибонуклеиновых кислот проводилось также посредством градиентного элюирования с колонки, наполненной фосфатом кальция.
