Хлорирование воды
В некоторых случаях может возникнуть необходимость хлорирования воды повышенными дозами хлора, т. е. применения так называемого перехлорирования, гарантирующего высокий эффект ее обеззараживания. После перехлорирования воды остаточная концентрация хлора в ней достаточно велика (1 .7 мг/л), поэтому приходится прибегать к последующему ее дехлорированию. Для этого чаще всего применяют обработку воды сульфитом натрия, сернистым газом и фильтрование дехлорируемой воды через активированный уголь. Дехлорирование воды сульфитом натрия, считая 3,5 мг (в расчете на Na2S03-7H20) на 1 мг связываемого хлора, протекает по уравнению
Na2S03 + Н20 + С12 = Na2S04 + 2НС1.
Дехлорирование воды сернистым газом (в соотношении, примерно 1:1) происходит в соответствии с уравнением
S02 + 2H2O + С12 → H2S04 + 2НС1.
При длительном пребывании питьевой воды перед поступлением к потребителям в резервуарах и водоводах (более 1,5 ч) для продления бактерицидного действия хлора, а также для предотвращения хлорфенольных запахов в воду кроме него вводят также и аммиак. Введение аммиака, кроме того, сокращает расход хлора и в ряде случаев улучшает вкус воды. При взаимодействии хлорноватистой кислоты (образовавшейся при хлорировании воды) с аммиаком получаются монохлорамины:
HOCI + NH3 → NH2CI + Н2О,
которые, гидролизуясь, образуют сильный окислитель — гипохлоритный ион:
NH2C1 + Н20 → NH4+ + ОСl-.
Гидролиз хлораминов протекает довольно медленно, поэтому в первое время окислительное действие хлораминов ниже, чем хлора, но длительность бактериального действия хлораминов значительно больше, в связи с чем и применяют аммонизацию воды перед длительным ее пребыванием в резервуарах, водоводах и сети. Соотношение доз хлора и аммиака зависит от качества исходной воды. Обычно оптимальной, обеспечивающей образование монохлораминов, является доза аммиака в пять-шесть раз меньше дозы хлора.
Аммиачное хозяйство организуют аналогично хлорному и располагают в отдельных помещениях. Аммиак хранят в расходном складе в баллонах или контейнерах. Ввод аммиака производят в фильтрат при наличии фенолов — за 2 . 3 мин до ввода хлора.
Различают свободный хлор (молекулярный хлор, хлорноватистая кислота и гипохлорит-ионы) и связанный (хлор, в виде хлораминов). Свободный хлор в 20—25 раз более бактерициден, чем связанный. С увеличением рН воды уменьшается содержание связанного хлора.
На бактерицидный эффект хлорирования значительно влияет первоначальная доза хлора и продолжительность сохранения в обрабатываемой воде его некоторой остаточной концентрации. Минимальная продолжительность контакта 30 мин при остаточном содержании свободного хлора 0,3—0,5 мг/л. Из патогенных микроорганизмов наиболее чувствительны к хлору: холерный вибрион, бациллы брюшного тифа и дизентерии. Паратиф В и микрокок более резистентны, на споровые формы хлор почти не действует.
Количество хлора, расходуемого на окисление примесей воды, называется хлоропоглощаемостью, которая определяется как разница между количеством введенного хлора и его концентрацией в воде через 30 мин контакта.
К числу производных хлора, используемых при обеззараживании, относят: гипохлориты натрия (NaClO*5H20), кальция [Са(С10)2], хлорит натрия (NaClO2), оксид хлора СlO2.
Гипохлорит натрия получают электролизом раствора поваренной соли в электролизере без диафрагмы. При этом вначале выделяются: на аноде — хлор, а на катоде — едкий натрий, которые взаимодействуя образуют гипохлорит натрия.
Гипохлорит кальция — стойкое вещество в виде белого порошка, содержащего до 90% продукта. Одним из способов получения является насыщение хлором водной суспензии гидроксида кальция при температуре 25—30 "С. Содержание активного хлора в гипохлорите кальция достигает 72% в зависимости от способа его получения.
Хлорит натрия — сильный окислитель, в твердом состоянии — негорюч и не самовоспламеняем. Его растворимость в0оде ПРИ 5 "С — 340, а при 60 °С — 550 г/л. При рН=2 он разлагается с образованием оксида хлора(IV) и соляной кис- доты, при рН около 4 разложение замедляется, а при рН=7 он не разлагается. Его широко используют для получения оксида хлора (IV). Оксид хлора (IV) — зеленовато-желтый газ с резким запахом, легко взрывается от электрической искры, при солнечном освещении и при нагревании свыше 60ºС. Взрывоопасен в обычных условиях при контакте со многими органическими веществами (нефть, бензин и пр.). Его окислительный потенциал в кислой среде 1,5 В. Растворимость оксида хлора (IV) в воде при 25°С — 81,06, а при 40 °С — 51,4 г/л. Его водные растворы имеют более интенсивную окраску по сравнению с хлорной водой. На водоочистных комплексах оксид хлора (IV) можно получать взаимодействием хлорита натрия и хлора или с разбавленной соляной кислотой, либо озоном. Он обладает более высоким бактерицидным и дезодорирующим действием, чем хлор. Присутствие в воде аммонийных солей не влияет на его окислительные свойства. При обработке вод, содержащих фенолы, не возникают хлорфенольные запахи, так как фенол практически полностью окисляется оксидом хлора(IV) до малеиновой кислоты и хинона, не имеющих в малых концентрациях запаха и привкуса.
Скорость процесса обеззараживания воды хлором и его производными определяется кинетикой диффузии оксиданта внутрь клетки и интенсивностью отмирания клеток вследствие нарушения метаболизма (обмена веществ). С ростом концентрации хлора в воде, повышением ее температуры и переводом его в сравнительно легко диффундирующую, недиссоциированную форму скорость процесса обеззараживания возрастает.
Бактерицидное действие хлора уменьшается с повышением рН воды. Поэтому обеззараживание воды хлором следует производить по возможности при более высоких температурах и низких значениях рН (до ввода щелочных реагентов). Содержащиеся в воде органические примеси, способные к окислению, восстановители, коллоидные и диспергированные вещества, обволакивающие бактерии, тормозят процесс обеззараживания воды.
Для дозирования в воду хлора, аммиака и сернистого газа (при дехлорировании) применяют вакуумные газодозаторы системы ЛОНИИ-100 (рис. 14.5) и системы Л. А. Кульского (рис. 14.6). Из баллонов, установленных на специальные весы (для контроля за расходом хлора), жидкий хлор передается в Промежуточный баллон, где происходит его испарение и отделение загрязняющих хлор примесей. Далее уже газообразный хлор проходит через фильтр со стекловатой (для окончательной очистки хлор-газа) и через понижающий давление редуктор. Степень понижения давления фиксируется двумя манометрами, установленными до и после редукционного клапана. С помощью диафрагмы создается перепад давлений, который служит импульсом для работы измерителя расхода хлора. Затем хлор, поступая в смеситель, смешивается с водопроводной водой, образуя хлорную воду, которая засасывается эжектором и отводится по назначению.
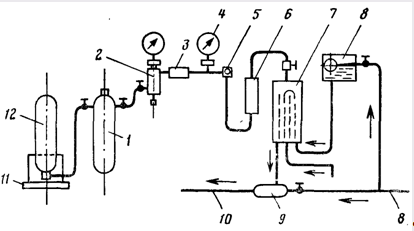
Рис. 14.5. Вакуумный хлоратор ЛОНИИ-100.
