Цепные неразветвлённые реакции. Тройные соударения и тримолекулярные реакции
Реакции 1 и 2 образуют звено цепи. Звено включает минимальный набор стадий, на которых образуется продукт реакции. Обрыв квадратичный, происходит на стенке (стадия 5).
![]()
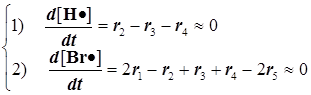
Подставляя уравнение 1) в уравнение 2), получаем:
![]()
![]()
![]() k1[Br2]= k5 [Br] 2
k1[Br2]= k5 [Br] 2 ![]()
Получаем также: а) 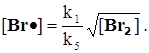 Подставляем этот результат в уравнение 1):
Подставляем этот результат в уравнение 1): ![]()
![]() Получаем:
Получаем:
б) 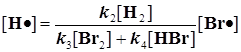 (8.1)
(8.1)
Далее простые преобразования, ведущие к целевому продукту:
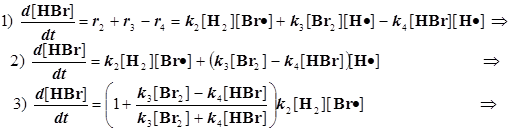 (8.2)
(8.2)
Конечное уравнение для скорости темновой реакции:
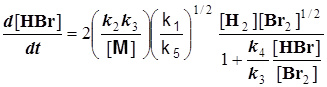 (8.3)
(8.3)
Конечное уравнение для скорости световой реакции:
При фотохимическом протекании реакции изменяется лишь описание 1-й стадии процесса. Инициирование происходит уже под действием фотонов: ![]() . И лишь те молекулы брома, что поглотили фотоны, далее способны участвовать в превращениях. Изменяя закон действующих масс для 1-й стадии, вместо концентрации брома вводим в него концентрацию фотонов. Её размерность эйнштейн (один моль - число Авогадро фотонов), и
. И лишь те молекулы брома, что поглотили фотоны, далее способны участвовать в превращениях. Изменяя закон действующих масс для 1-й стадии, вместо концентрации брома вводим в него концентрацию фотонов. Её размерность эйнштейн (один моль - число Авогадро фотонов), и ![]() . Обычно необходимая в кинетическом уравнении, обратная времени, раз мерность входит с константой скорости. В уравнение фотохимической 1-й стадии она появляется вместе с «концентрацией» фотонов, которая есть не что иное, как интенсивность излучения – энергия, доставляемая в реагирующую систему в единицу времени:
. Обычно необходимая в кинетическом уравнении, обратная времени, раз мерность входит с константой скорости. В уравнение фотохимической 1-й стадии она появляется вместе с «концентрацией» фотонов, которая есть не что иное, как интенсивность излучения – энергия, доставляемая в реагирующую систему в единицу времени:
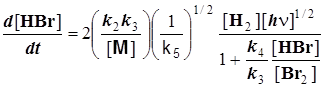 (8.4)
(8.4)
Скорость этой реакции не приводится к эффективному выражению степенного вида. Напротив, скорость родственного цепного процесса (H2 +Cl2 =HCl), приводится к более простой форме, и можно видеть, как отдельные стадии сложного цепного процесса формируют эффективную (наблюдаемую) энергию активации.
Отличительная черта большинства цепных процессов состоит в том, что участниками их промежуточных элементарных стадий являются активные частицы – свободные радикалы. Их образование происходит на стадиях зарождения цепи. После образования частиц продукта активные центры из зоны реакции исчезают на стадиях обрыва цепи.
Цепные неразветвлённые реакции-II.
Пример 2: Реакция Cl2 + H 2 = HCl .
Первая стадия - фотохимическое инициирование.
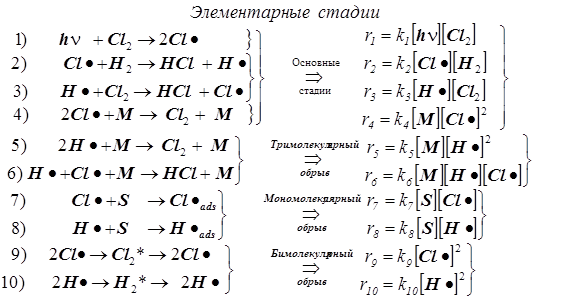
1) Стадия 1 –зарождение цепи.
2) Стадии (2, 3) - продолжение цепи, и вместе они образуют звено цепи.
Суммируя правые и левые части обоих уравнений 2 и 3, находим, что суммарное превращение, протекающее в звене цепи, является основной реакцией .
3) Стадия 4 предполагается основной элементарной реакцией обрыва в силу того, что с её помощью объясняется экспериментально наблюдаемый факт, по которому скорость реакции заметно уменьшается в присутствие примесей.
4) Полный набор стадий обрыва включает в себя и другие элементарные реакции:
тримолекулярные (4, 5, 6), мономолекулярные (7, 8), бимолекулярные (9, 10).
5) За суммарную скорость всей реакции ответственны стадии (1, 2, 3, 4).
6) Прочие стадии малосущественны, т.к. на результирующей скорости суммарной реакции обрыв мономолекулярный и бимолекулярный заметно не сказываются.
7) При выводе скорости r всего процесса используем два уравнения для квазистационарных концентраций свободных валентностей® радикальных частиц® атомов H• и Cl•:
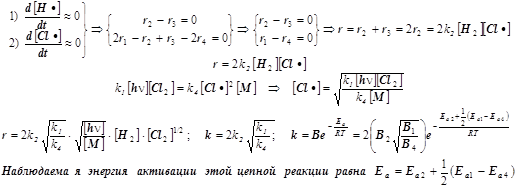
Этот сравнительно простой пример приводит к понятию эффективной энергии активации.
Она является результирующей характеристикой совокупности нескольких стадий сложной реакции. В условиях проведения реального эксперимента наблюдаемые эмпирические активационные параметры очень часто приходится использовать на первых этапах кинетических исследований, пока детали сложного многостадийного механизма превращения остаются ещё невыясненными.
8) Средняя длина цепи определяется как отношение скоростей образования продукта к скорости инициирования (в нашем случае фотохимического) цепи, т.е.: n=r/r1.
Важно! Обратиться к анализу энергий активации (см. книгу под ред.Краснова, стр. 607).
Энергии активации отдельных стадий примерно равны:
- при взаимодействии двух радикалов - нулю.
- при диссоциации молекул хлора - примерно половине энергии связи 238/2 кДж/моль.
- при взаимодействии атома хлора с молекулой водорода примерно 25 кДж/моль.
Получается энергия активации всей реакции, примерно равная 119/2 + 25 = 85 кДж/моль.
