Цинк и его свойства
![]()
Карбид цинка ![]() довольно нестойкое соединение, которое легко разлагается водой и кислотами. 6. Оксиды и гидроксиды данного химического элемента.
довольно нестойкое соединение, которое легко разлагается водой и кислотами. 6. Оксиды и гидроксиды данного химического элемента.
6.1. Запишите ряд оксидов данного химического элемента (прогноз по электронной формуле и ковалентности).
Решение.
Для цинка характерна степень окисления +2. поэтому цинк имеет только один оксид: ZnO. Другие оксиды цинка неизвестны. Возможно существование пер оксида цинка ZnO2. ковалентность цинка в пер оксиде равна двум, строение его молекулы приведено на рисунке.

Ковалентность цинка в оксиде ZnO равна двум.
Запишем электронную формулу для ZnO:

6.2. Прогнозируйте характер оксидов (основной, кислотный, амфотерный) по величине Э.О. и правилу химических свойств ряда оксидов.
Решение.
Во второй побочной подгруппе периодической системе кроме цинка находится также и кадмий и ртуть. Все эти металлы имеют основные оксиды, кадмий проявляет также и амфотерные свойства. Поэтому можно прогнозировать, что оксид цинка будет проявлять также амфотерные свойства.
Рассмотрим электроотрицательности оксида цинка:
![]()
Разница электронегативностей для ZnO равна 3,5 – 1,8 = 1,7. Для основных оксидов Na2O, CaO, BaO эта разница составляет около 2,5, а для кислотных оксидов SO2, SO3, P2O5 около 1÷1,3. как видно оксид цинка лежит посредине этих значений, как металл он будет обладать амфотерными свойствами.
6.3. Запишите соответствующие гидроксиды (основания и кислоты). Определите принадлежность к сильным или слабым электролитам.
Решение.
Для цинка характерен только один гидроксид.
Поскольку цинк двухвалентен, то формула гидроксида цинка имеет вид: ![]() . Гидроксид цинка выделяется из растворов солей цинка при действии щелочей в виде белого аморфного осадка. При стоянии он постепенно приобретает кристаллическую структуру. Скорость кристаллизации зависит от раствора соли из которой она кристаллизируется. Так из растворов хлоридов гидроксид цинка кристаллизируется значительно быстрее чем из растворов нитратов.
. Гидроксид цинка выделяется из растворов солей цинка при действии щелочей в виде белого аморфного осадка. При стоянии он постепенно приобретает кристаллическую структуру. Скорость кристаллизации зависит от раствора соли из которой она кристаллизируется. Так из растворов хлоридов гидроксид цинка кристаллизируется значительно быстрее чем из растворов нитратов.
Гидроксид цинка владеет амфотерными свойствами (с преобладанием основных свойств), константа диссоциации основания равна ![]() , а кислоты
, а кислоты ![]() . Произведение растворимости гидроокиси цинка равно
. Произведение растворимости гидроокиси цинка равно ![]() . Есть данные, что у свежеосажденного гидроксида цинка она несколько больше и составляет
. Есть данные, что у свежеосажденного гидроксида цинка она несколько больше и составляет ![]() .
.
6.4. Составьте уравнения реакций, подтверждающих характер гидроксидов о молекулярном и ионном виде.
Решение.
Гидроксид цинка владеет амфотерными свойствами. Он реагирует как с кислотами так и с щелочами. С кислотами гидроксид цинка дает соли цинка, например:
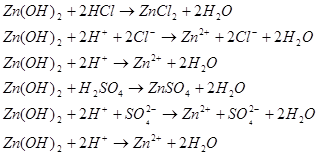
В щелочном растворе гидроокись цинка ведет себя как ангидридокислота, то есть переходит в раствор в виде гидроксоцинкат-ионов за счет присоединения ионов гидроксила. Известны соли три-, тетра- и гексагидроксоцинкатов, например: ![]()
![]()
![]() .
.
Некоторые из цинкатов выделены в твердом состоянии: ![]()
![]()
![]() . Они образуются только при избытке щелочи.
. Они образуются только при избытке щелочи.
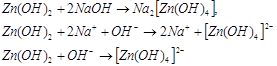
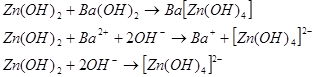
Некоторые из полученных соединений содержат криталлизационную воду. В большинстве случаев последняя легко отцепляется при нагревании. Конституционно связанная вода удерживается в таких соединениях довольно крепко, например при нагревании ![]() до температуры 465ºС потери воды не происходит.
до температуры 465ºС потери воды не происходит.
Цинкаты также могут быть получены при сплавлении окиси цинка и окисей других металлов, но полученные таким образом цинкаты не растворимы в воде.
6.5. Напишите уравнения реакций электролитической диссоциации гидроксидов.
Решение.
Гидроксид цинка вещество довольно мало растворимое, но он все же диссоциирует на ионы, хотя и в малой мере. Произведение растворимости ![]() равно
равно ![]() . Рассчитаем содержание иона цинка в растворе
. Рассчитаем содержание иона цинка в растворе ![]() ,
, ![]()
В водных растворах ![]() диссоциирует на ионы согласно уравнения:
диссоциирует на ионы согласно уравнения:
![]() .
.
Но поскольку ![]() мало растворим, то диссоциация протекает незначительно.
мало растворим, то диссоциация протекает незначительно.
7. Может ли данный химический элемент образовывать комплексные соединения? Если да, то, какие (кислоты, основания, соли)? Приведите примеры.
Решение.
Цинк может образовывать комплексные соединения. Комплексы цинк образовывает с аммиаком, цианидами, гидразином, роданидами, а также с многими органическими веществами, например акридином, пирамидоном, дифенилгуанидином, некоторыми органическими красителями. Отсутствие в комплексах цинка стабилизации полем лигандов приводит к тому, что их стереохимия зависит только от размера и от электростатической и ковалентной составляющей связи. Комплексы цинка могут быть тетраэдрическими - ![]() или октаэдрическими -
или октаэдрическими - ![]() .
.
С аммиаком были выделены комплексные соединения состава: ![]() ,
, ![]() ,
, ![]() . Комплексы с 6 молекулами аммиака были получены только в сухом виде.
. Комплексы с 6 молекулами аммиака были получены только в сухом виде.
Известно значительное число комплексов цинка с органическими соединениями основного характера. В зависимости от условий могут образовываться соединения двух типов. К первому из них относятся соединения, где органический реагент непосредственно связан с ионом цинка и образует типичный комплекс внесения. Ко второму типу можно отнести соединения, в которых органическое основание играет роль катиона, дающего соли с другими ацидокомплексными анионами цинка. Эти соединения » характеру связи с органическими реагентами по существу относятся к обычным ионным ассоциатам.
