Электронное строение атома. Периодический закон
Квантовое состояние атома с наименьшей энергией – основное состояние, а с более высокой – возбуждённое состояние. Переход электрона с одного уровня на другой сопровождается либо поглощением, либо выделением энергии: ![]() .
.
Побочное квантовое (орбитальное, азимутальное) число ![]() (принимает все целочисленные значения от 0 до (n-1)).
(принимает все целочисленные значения от 0 до (n-1)).
|
|
|
Орбиталь |
|
1 |
0 |
1s |
|
2 |
0,1 |
2s,2p |
|
3 |
0,1,2 |
3s,3p,3d |
Состояние электрона характеризующееся различными значениями побочного квантового числа ![]() называется энергетическим подуровнем. В пределах каждого уровня с увеличением
называется энергетическим подуровнем. В пределах каждого уровня с увеличением ![]() , растёт энергия орбитали.
, растёт энергия орбитали.
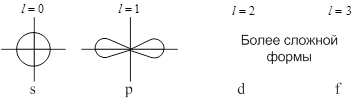
Каждому значению ![]() соответствует определённая форма орбитали (например, при
соответствует определённая форма орбитали (например, при ![]() – это сфера, центр которой совпадает с ядром).
– это сфера, центр которой совпадает с ядром).
Магнитное квантовое число ![]() характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от -
характеризует ориентацию орбитали в пространстве (принимает все целочисленные значения от - ![]() до +
до +![]() ).
).
Например, для ![]()
![]() . В пределах каждого подуровня орбиталь имеет одинаковую энергию.
. В пределах каждого подуровня орбиталь имеет одинаковую энергию.
Спиновое квантовое число ![]() характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения:
характеризует вращательный момент, который приобретает электрон в результате собственного вращения вокруг своей оси (принимает два значения: ![]() – вращение по часовой стрелке,
– вращение по часовой стрелке, ![]() – вращение против часовой стрелки).
– вращение против часовой стрелки).
Атомные орбитали заполняются электронами в соответствии с 3-мя принципами:
Принцип устойчивости (принцип min энергии): Каждая новая орбиталь заполняется только после того, как будут заполнены все предыдущие, т.е. более устойчивые (с min энергией) орбитали.
Энергия атомных орбиталей возрастает следующим образом:
![]()
Правило Клечковского: заполнение электронами атомных орбиталей происходит в соответствии с увеличением суммы главного ![]() и побочного
и побочного ![]() квантовых чисел; если
квантовых чисел; если ![]() одинакова, то атомная орбиталь заполняется от больших
одинакова, то атомная орбиталь заполняется от больших ![]() и меньших
и меньших ![]() к меньшим
к меньшим ![]() и большим
и большим ![]() .
.
|
|
|
|
Орбиталь |
|
1 |
0 |
1 |
1s |
|
2 |
0 |
2 |
2s |
|
1 |
3 |
2p | |
|
3 |
0 |
3 |
3s |
|
1 |
4 |
3p | |
|
2 |
5 |
3d | |
|
4 |
0 |
4 |
4s |
|
1 |
5 |
4p | |
|
2 |
6 |
4d | |
|
3 |
7 |
4f | |
|
5 |
0 |
5 |
5s |
|
1 |
6 |
5p | |
|
2 |
7 |
5d | |
|
3 |
8 |
5f | |
|
4 |
9 |
5g | |
|
6 |
0 |
6 |
6s |
Принцип Паули: в атоме не может быть 2 электрона, у которых 4 одинаковых квантовых числа. Следовательно, на 1-ой орбитали могут находиться не более 2-х электронов, отличающихся друг от друга значением спинового квантового числа. Отсюда следует, что максимальное количество электронов на энергетическом уровне ![]() , на энергетическом подуровне
, на энергетическом подуровне ![]() .
.
Пример:
![]()
![]()
![]()
Правило Хунда: электроны располагаются на орбиталях равной энергии таким образом, чтобы их суммарный спин был максимальный. Это означает, что первоначально электроны заполняют все свободные орбитали данного подуровня по 1-му, имея при этом параллельные спины, и только потом происходит заполнение этих орбиталей 2-ми электронами.
