Электрохимические методы защиты металлов от коррозии
Если не пользоваться гальваническим элементом, а просто погрузить металл в раствор, содержащий окислитель, то стационарное состояние будет возможно только в том случае, если скорость реакции окисления металла (1) будет равна скорости восстановления окислителя (2).
Это означает, что при стационарном потенциале ![]() скорость анодного процесса (окисления) равна скорости катодного процесса (восстановления). Равенство скоростей реакций (1) и (2) выражено на рис.1 равенством ординат (сил тока), отвечающих
скорость анодного процесса (окисления) равна скорости катодного процесса (восстановления). Равенство скоростей реакций (1) и (2) выражено на рис.1 равенством ординат (сил тока), отвечающих ![]() . Необходимо подчеркнуть, что в этом случае нет электрического тока, доступного непосредственному измерению. Слово «ток» означает, что число частиц (или грамм-частиц), прореагировавших на поверхности металла, можно выразить в единицах силы тока. Если площадь поверхности электрода
. Необходимо подчеркнуть, что в этом случае нет электрического тока, доступного непосредственному измерению. Слово «ток» означает, что число частиц (или грамм-частиц), прореагировавших на поверхности металла, можно выразить в единицах силы тока. Если площадь поверхности электрода ![]() , то
, то ![]() и
и ![]() , где
, где ![]() и
и ![]() - плотности анодного и катодного токов, соответственно. Для рассматриваемого случая условие стационарности можно выразить через
- плотности анодного и катодного токов, соответственно. Для рассматриваемого случая условие стационарности можно выразить через ![]() или через
или через ![]() , если принять, что обе реакции протекают на поверхности одной и той же величины
, если принять, что обе реакции протекают на поверхности одной и той же величины ![]() .
.
На рис.1 изображены анодная а и катодная к поляризационные кривые для данного металла в растворе определенного состава и для данного окислителя на поверхности того же металла. Наклон кривых а и к определяет кинетику процесса. Таким образом, рисунок содержит сведения о термодинамической возможности коррозии данного металла некоторым окислителем и о скорости этого процесса, определяемой кинетикой реакций (1) и (2), т.е. зависимостью их скоростей от смещения соответствующих потенциалов от равновесного значения. Коррозия возможна только в том случае, если ![]() . Если
. Если ![]() и
и ![]() или
или ![]() , то окисление металла невозможно (рис.2 ).
, то окисление металла невозможно (рис.2 ).
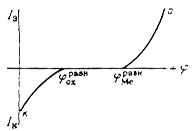
Рис. 3. Поляризационные кривые, отвечающие случаю, когда ![]() ; при этом
; при этом ![]() и коррозия металла данным окислителем невозможна.
и коррозия металла данным окислителем невозможна.
Легко понять, что при данном ![]() скорость коррозии может быть различной, если поляризационные кривые а и к идут с различными наклонами. Та кривая, которая отвечает более высокому перенапряжению (идет более полого), будет определять в основном скорость процесса. Так, при большом перенапряжении реакции (2) получим случай так называемого катодного контроля, когда кинетика определяется скоростью катодной реакции; при этом
скорость коррозии может быть различной, если поляризационные кривые а и к идут с различными наклонами. Та кривая, которая отвечает более высокому перенапряжению (идет более полого), будет определять в основном скорость процесса. Так, при большом перенапряжении реакции (2) получим случай так называемого катодного контроля, когда кинетика определяется скоростью катодной реакции; при этом ![]() близок к
близок к ![]() . При большом перенапряжении реакции (1) получим анодный контроль; при этом
. При большом перенапряжении реакции (1) получим анодный контроль; при этом ![]() близок к
близок к ![]() (рис.3).
(рис.3).
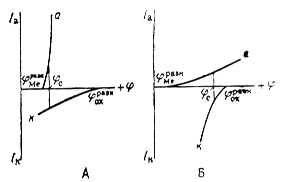
Рис. 4. Коррозионные диаграммы, отвечающие катодному контролю (А) и анодному контролю (Б).
Рассматривая рис.1 и 3, мы видим, что окислитель, восстанавливаясь, заставляет потенциал металла сдвинуться от равновесного в сторону более положительных значений. Можно, сказать, что металл поляризован окислителем, если под поляризацией понимать навязывание электроду потенциала, отличного от равновесного. И не совсем понятно, почему в современной литературе, особенно коррозионной, окислитель часто называют деполяризатором. Так, коррозию в кислотах, когда металл окисляется ионами Н+, навязывающими ему потенциал более положительный, чем равновесный, называют «коррозией с водородной деполяризацией», коррозию при окислении металла кислородом – «коррозией с водородной деполяризацией». Мы останавливаемся на этом мелком вопросе потому, что название «деполяризатор» вместо «окислитель» искажает химическую природу явления. Окислитель поляризует металл, сообщая ему сверх равновесного потенциала некоторую величину ![]() , вызывающую окисление, а не снижает
, вызывающую окисление, а не снижает ![]() , т.е. не деполяризует металл.
, т.е. не деполяризует металл.
Другие способы изображения коррозионных диаграмм
Применяемый в этой главе способ рассмотрения процессов коррозии при помощи поляризационных диаграмм весьма распространен. В том виде, в котором мы его использовали выше, он был предложен К. Вагнером и В. Траудом и подробно разработан А. М. Шультиным Способ этот характеризуется тем, что анодный и катодный токи, выражающие скорость противоположных по химическому смыслу процессов, откладываются в противоположные стороны от оси абсцисс. По оси абсцисс откладывается потенциал.
Однако весьма распространен и другой метод, предложенный Ю. Р. Эвансом, при котором ток, измеряющий скорость окисления и восстановления, откладывается в одном направлении и принимается за аргумент (абсцисса). Потенциал (ордината) откладывается так, что иногда вверх растет положительное значение, а иногда – отрицательное
Легко убедиться, что все способы изображения коррозионных диаграмм по существу равноценны. Дальше мы будем использовать различные способы изображения, для того чтобы научиться разбираться и в тех, и в других.
Методы защиты металлов от коррозии.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Коррозионные диаграммы, наиболее полно характеризующие коррозионный процесс, должны отражать и те изменения в ходе протекания, какие наблюдаются в условиях защиты. Коррозионные диаграммы можно использовать, поэтому при разработке возможных путей предохранения металлов от коррозии. Они служат основой для выяснения принципиальных особенностей того или иного метода. В связи с этим при рассмотрении существующих методов защиты поляризационные диаграммы будут использованы в их несколько упрощенном виде (4). На таких диаграммах постулируется линейная зависимость между плотностью и потенциалом каждой частной реакции. Это упрощение оказывается вполне допустимым при качественной оценке особенностей большинства методов
