Этилен и его производные в промышленном органическом синтезе
Абсорбционная колонна представляет собой вертикальный цилиндрический аппарат, выложенный внутри кислотоупорным кирпичом. Внутри цилиндра имеются тарелки с колпачками и змеевиковые холодильники, изготовленные из хромоникелевой стали. На верхнюю тарелку абсорбера подаётся насосом 97-98%-ная серная кислота. К этой кислоте уже в абсорбере добавляется некоторое количество кислоты, содержащей диэтилсульфат и этилсульфат. Такая смесь лучше поглощает этилен, чем чистая серная кислота. Происходит поглощение этилена с образованием этилсерной кислоты и диэтилсульфата. Эта реакция экзотермическая. Для поддержания нужной температуры необходимо непрерывно отводить избыточное тепло, что и осуществляется при помощи водяных холодильников.
Газ, отходящий из верхней части абсорбера, промывается в специальных скрубберах 2 - водой и 3 - щёлочью и используется или для пиролиза, или в качестве топлива.
Вытекающий из нижней части абсорбера экстракт, представляющий собой смесь соляной кислоты с этил- и диэтилсульфатом, охлаждается в холодильнике 4 до 40°С и смешивается с водой. Из смесителя 5 охлаждённый экстракт направляется в гидролизёр 6 типа тарельчатой колонны, где при t°=80-90°С идёт реакция гидролиза с образованием спирта.
Гидролизат, содержащий, кроме спирта, ещё и дтэтиловый эфир, соляную кислоту и небольшое количество побочных продуктов, подаётся в отгонную колонну 7. Здесь происходит отгонка эфира, спирта и других легколетучих веществ и одновременно заканчивается гидролиз оставшейся этилсерной кислоты. В нижнюю часть колоны 7 подаётся острый пар.
Пары спирта-сырца после нейтрализации раствором щёлочи в колонне8 направляются на очистку и ректификацию. После ректификации получается этиловый спирт-ректификат (95% объёмных), практически ничем не отличающийся от спирта, получаемого путём брожения.
В качестве побочного продукта выделяется диэтиловый эфир в количестве около 10% от спирта-ректификата.
Недостатками сернокислотного метода является большой расход серной кислоты (на 1 кг спирта берётся 1,8-2 кг серной кислоты в пересчёте на моногидрат) и сильная коррозия многих частей аппаратуры.
Непосредственное присоединение воды к этилену давно являлось заманчивым делом, но на пути к осуществлению этой реакции стоял целый ряд затруднений. Реакция является обратимой и идёт с выделением теплоты:
В результате исследований и промышленных испытаний установлены следующие основные условия взаимодействия газообразного этилена и водяных паров:
1. Температура 275-300°С;
2. Давление при гидратации 65-75 атм;
3. Концентрация этилена в циркулирующем газе 85% (объёмных);
4. Молярное отношение воды к этилену 0,7:1;
5. Концентрация применяющейся здесь фосфорной кислоты в плёнке катализатора не ниже 83%;
6. За 1 час проходит 1800 м3 газа через кубометр катализатора.
Для сдвига равновесия в сторону гидратации этилена
необходимо понижение температуры и повышение давления. Процесс прямой гидратации этилена состоит из несколько непрерывно протекающих стадий:
1. Компрессия исходного этилена до давления, необходимого для гидратации, и возвращение не прореагировавшего этилена;
2. Приготовление исходной парогазовой смеси;
3. Гидратация этилена;
4. Нейтрализация фосфорной кислоты, уносимой из зоны реакции;
5. Охлаждение парогазовой смеси и конденсация паров спирта и воды;
6. Очистка циркулирующего газа.
Установка получения этилового спирта каталитической гидратацией этилена представлена на рисунке 3.
Рисунок 3
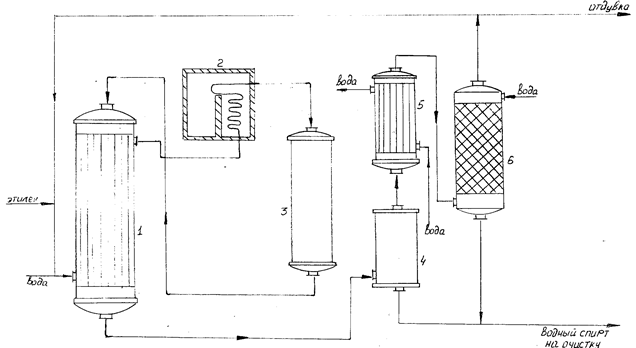
1. - теплообменник
2. - печь
3. - реактор
4. - ёмкость для спирта-сырца
5. - холодильник
6. - промывная колонна.
Парофазная каталитическая гидратация этилена является
более перспективным методом, и наша промышленность сейчас ориентируется на этот более прогрессивный метод.
Синтетический этиловый спирт требует для своего производства гораздо меньше трудовых затрат, он аналогичен по составу и качеству спирту, получаемому из пищевых продуктов, и широко применяется в различных отраслях промышленности.
Окись этилена и синтезы на её основе
Целый ряд весьма важных промышленных синтезов основан
на применении в качестве исходного продукта окиси этилена.
Окись этилена можно отнести к числу таких же "строительных кирпичей" в органическом синтезе, как формальдегид, ацетилен и некоторые другие соединения. Окись этилена получена впервые в 1857 году французским химиком Вьюрцем, но практическое использование её интересных химических свойств началось тогда, когда сам этилен стал более доступным продуктом. Работы П.В. Зимакова с сотрудниками по окиси этилена послужили основой для организации в нашей стране целого ряда новых отраслей промышленности.
Окись этилена при обычных условиях представляет собой газ, легко сгущающийся в бесцветную жидкость с t°кип.=13,5°С, имеющую эфирный, немного резкий запах и жгучий вкус. Смешивается с водой и спиртом в любых отношениях, вступая с ним во взаимодействие. Это нейтральное вещество, обладающее весьма высокой реакционной способностью, которая связана с особенностями в строении молекулы - наличием трёхчленного цикла с атомом кислорода в качестве связующего звена.
Окись этилена получают двумя методами: прямым окислением этилена
\ /
О
и действием щелочей на хлоргидрин этилена
\ /
О
Главные задачи при технологическом осуществлении первого метода заключаются в выборе условий, исключающих возможность взрыва смеси этилена с кислородом и обеспечивающих образование окиси этилена в качестве главного продукта реакции.
По второму методу этилен сначала обрабатывают хлорноватистой кислотой НСlО для получения хлоргидрина, который кипячением с известковым молоком или щелочами превращается в окись этилена.
Этот процесс осуществляется в колонне с насадкой из керамических колец при температуре 70°С. Выход окиси этилена по этому методу достигает 75% от теоретического.
В присутствии слабых оснований в этой реакции образуется главным образом этиленгликоль:
