Активность карбоксипептидазы N и ангиотензинпревращающего фермента в сыворотке крови у онкологических больных при химиотерапевтическом воздействии
Таким образом, существуют механизмы поддерживающие баланс между участием NO как в прометастатических, так и в антиопухолевых реакциях [42].
ГЛАВА 2. Материалы и методы исследования
2.1 Материал исследования
Активность ферментов определяли в сыворотке крови онкологических больных. Кровь брали из локтевой вены, далее ее инкубировали 30 минут при комнатной температуре, центрифугировали 20 минут при 4000 g и получали сыворотку, в которой определяли активность карбоксипептидазы N и ангиотензинпревращающего фермента.
Изучение активности ферментов было проведено у 24 мужчин в возрасте от 49 до 70 лет с опухолями легких, желудочно-кишечного тракта, мочеполовой системы. Больные подвергались химиотерапевтическому воздействию. Они составили две экспериментальные группы. Первая группа – больные до начала проведения им химиотерапии (12 человек); вторая – те же больные, но после окончания курса лечения (12 человек). В качестве контроля выступала группа из 13 здоровых мужчин такого же возраста.
2.2 Методы исследования
2.2.1 Метод определения активности карбоксипептидазы N
Активность КПN определяли в сыворотке крови нингидриновым методом [61].
Опытные пробы содержали 20 мкл 3,5 мМ раствора CoSO4, приготовленного на 100 мМ Трис-HCl буфере, pH 7,6 и 40 мкл препарата фермента. Контрольные пробы содержали 20 мкл 100 мМ Трис-HCl, pH 7,6 и 40 мкл препарата фермента. Пробы преинкубировали 8 мин при 37oC, реакцию начинали прибавлением в опытные пробы 10 мкл гиппурил-арг, приготовленного на 100 мМ Трис-HCl буфере, pH 7,6 (конечная концентрация в пробе 5 мкМ). Реакцию проводили 120 мин при 37oC и останавливали прибавлением 30 мкл 10 % трихлоруксусной кислоты.
Пробы центрифугировали 20 мин при 4000 об/мин, отбирали 50 мкл надосадочной жидкости, приливали 1 мл нингидринового реактива. Далее пробы встряхивали, выдерживали 12 мин на кипящей водяной бане и измеряли оптическую плотность на КФК-2 при 595 нм против H2O.
Активность КПN определяли как разность оптической плотности опытных и контрольных проб и выражали в нмоль аргинина, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Концентрацию белка в пробах определяли биуретовым методом.
2.2.2 Метод определения активности ангиотензинпревращающего фермента
Активность АПФ определяли в сыворотке крови нингидриновым методом по образованию гли-арг из кбз-гли-гли-арг при рН 8,2 как активность, ингибируемую каптоприлом. Препарат фермента (40 мкл) смешивали с 20 мкл 35 мкМ каптоприла в 100 мМ Трис-НСl буфере, рН 8,2, или 20 мкл буфера и преинкубировали 8 мин при 37˚С. Реакцию начинали прибавлением 10 мкл раствора кбз-гли-гли-арг в вышеуказанном буфере (конечная концентрация в пробе 5 мкМ). Через 120 мин реакцию останавливали прибавлением 30 мкл 10% раствора трихлоруксусной кислоты [59]. Пробы центрифугировали 30 мин при 4000 об/ мин. Отбирали 50 мкл надосадочной жидкости и определяли количество образовавшегося гли-арг нингидриновым методом [61]. Пробы колориметрировали на КФК-2 при l=590 нм. Активность АПФ определяли как разность в оптической плотности проб не содержащих и содержащих каптоприл. Активность фермента выражали в нмоль гли-арг, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка. Концентрацию белка определяли биуретовым методом.
2.2.3 Метод определения содержания белка
Содержание общего белка определяли биуретовым методом. Принцип метода основан на том, что ионы меди в щелочной среде взаимодействуют с пептидными связями белков сыворотки крови с образованием комплекса красного цвета, интенсивность окраски которого пропорциональна концентрации общего белка.
Опытные пробы содержали 50 мкл сыворотки крови и 2,5 мл рабочего раствора биуретового реагента (концентрат биуретового реагента развести дистиллированной водой в соотношении 1:19). Контрольные пробы содержали 50 мкл дистиллированной воды и 2,5 мл рабочего раствора биуретового реагента. В калибровочную пробу добавляли 50 мкл калибровочного раствора общего белка (раствор бычьего сывороточного альбумина с концентрацией 60 г/л с добавлением хлористого натрия 9 г/л и азида натрия 1 г/л).
Содержимое пробирок тщательно перемешивали, избегая образования пены, инкубировали при комнатной температуре (+ 18 - 25![]() С) в течение 30 минут, после чего измеряли величину оптической плотности калибровочной и опытных проб против контрольной пробы при длине волны 540 нм.
С) в течение 30 минут, после чего измеряли величину оптической плотности калибровочной и опытных проб против контрольной пробы при длине волны 540 нм.
Концентрацию общего белка рассчитывали, как отношение оптической плотности опытной пробы к оптической плотности калибровочной пробы умноженная на концентрацию общего белка в калибровочном растворе (60 г/л).
2.2.4 Метод количественного определения NO в сыворотке крови
Для определения концентрации NO 0,5 мл сыворотки депротеинизировали добавлением 1 мл 0,5 н. раствора NaOH и 10 % раствора ZnSO4 для осаждения белковых компонентов. Пробы центрифугировали при 5000 об/мин. 30 мин. К 1мл надосадочной жидкости добавляли равное количество 1 % раствора реактива Грисса и инкубировали в течение 10 мин. при 25![]() С. Затем колориметрировали при 540 нм против контрольной пробы. Содержание NOоценивали по количеству конченого стабильного метаболита оксида азота (II) – нитрит иона. Суммарную концентрацию нитрит-иона определяли колориметрически по развитию окраски в реакции диазотирования нитритом сульфаниламида, входящего в реактив Грисса. Количество нитрит-иона выражали в мкг на мл.
С. Затем колориметрировали при 540 нм против контрольной пробы. Содержание NOоценивали по количеству конченого стабильного метаболита оксида азота (II) – нитрит иона. Суммарную концентрацию нитрит-иона определяли колориметрически по развитию окраски в реакции диазотирования нитритом сульфаниламида, входящего в реактив Грисса. Количество нитрит-иона выражали в мкг на мл.
2.3 Статистическая обработка результатов исследования
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента [16]. Корреляционный анализ проводили с помощью программы «Статистика» (версия 6.0).
ГЛАВА 3. Результаты и обсуждение
3.1 Исследование активности карбоксипептидазы N в сыворотке крови онкологических больных при химиотерапевтическом воздействии
Результаты исследования показали увеличение активности КПN у онкологических больных в период до проведения химиотерапии по сравнению с контрольной группой в 2 раза, и уменьшение активности фермента после проведения химиотерапии, по отношению к периоду до начала лечения в 2,6 раза (рис.1).
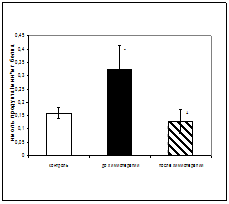
Рис.1. Активность КПN у онкологических больных при химиотерапевтическом воздействии (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, M±m, n=12¸18; достоверность отличий: * - p< 0,05 относительно контроля, + - p<0,05 относительно до химиотерапии).
Калликреин-кининовая система, к которой относится и КПN играет не только центральную роль в процессах гемокоагуляции и фибринолиза, но и контролирует различные стадии развития злокачественных новообразований [52,63]. Возрастание активности КПN у онкологических больных, вероятно, опосредованно через уменьшение уровня брадикинина может препятствовать высвобождению фактора некроза опухолей (TNFa), способного лизировать большой набор опухолевых клеток in vivo и in vitro. Цитотоксическое действие TNFa на опухолевую клетку связано с деградацией ДНК и нарушением функционирования митохондрий. Таким образом, увеличение активности КПN может способствовать прогрессии опухоли. Снижение активности КПN после химиотерапии до уровня контрольных значений может указывать на существенный противоопухолевый эффект данного терапевтического воздействия. Таким образом, динамическое исследование активности фермента в сыворотке крови больных до и после химиотерапии может быть использовано в качестве дополнительных биохимических критериев при наблюдении за эффективностью проводимого лечения [6,33].
