Антигены
При антигенном анализе продуктов протеолиза белков желательно использовать антисыворотки от нескольких животных, полученные в различные сроки после иммунизации. Так, в случае изучения антигенной структуры белка вируса табачной мозаики было установлено, что индивидуальные антисыворотки кроликов реагируют, как правило, с С-концевым декапептидом, но часть антисывороток содержит антитела против N-концевого дека-пептида. Антитела к С-концевому декапептиду от некоторых кроликов взаимодействуют с пептидом, от которого отщеплен С-концевой аргинин, в то время как антитела от других кроликов распознают детерминанту только при наличии С-концевиго аргинина. Для наглядности приводим структуру указанного пептида:
![]()
Полученные в ранние сроки после иммунизации антитела кролика против растворимого коллагена из кожи крыс реагируют с детерминантами в С-концевой части молекулы, а «поздние» антитела взаимодействуют также с N-концевым участком.
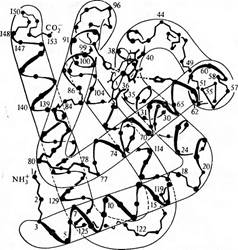
Строение молекулы миоглобина кашалота
При иммунизации кроликов лизоцимом из яиц кур антитела появляются впервые через 10 дней. Но только через 2—3 месяца накапливаются определимые их количества, реагирующие с пептидами, которые включают остатки с 1 по 20 и с 60 по 83, поперечно связанные дисульфидной связью с остатками 123—129.
Закономерен вопрос, нельзя ли избежать отмеченных выше трудностей антигенного анализа, отказавшись от традиционной техники получения антител в результате иммунизации и оперируя вместо этого моноклинальными антителами, полученными с помощью гибридомной техники. Очезидно, что для детального анализа антигенной структуры, например белков, необходимо использование большого числа индивидуальных клонов. Чтобы учесть генетические особенности иммунного ответа индивидуальных реципиентов, придется производить слияние с клетками плазмацитомы лимфоидных клеток от генетически неидентичных особей, отбор которых может быть лишь случайным. Тем самым степень неопределенности задачи не уменьшится.
Продолжив рассмотрение вопроса о строении детерминантных групп белков, проанализируем один из широко применявшихся для этих целей методов, связанных с химической модификацией боковых аминокислотных остатков в глобулярных белках. Такое воздействие оказывает влияние на их антигенные свойства. В результате модификации изменяется, как правило, конформация молекулы. Так, модификация с помощью ангидрида янтарной кислоты 32 и 57 аминогрупп в молекуле бычьего сывороточного альбумина уменьшает способность белка взаимодействовать с антителами на 8 и 65% соответственно. Измерение при этом объема молекулы модифицированного альбумина, оцененное по величине стоксовского радиуса, показало, что в первом случае он возрастает на 27%, а во втором — уже на 78%. Следовательно, увеличение степени гидратации модифицированного белка за счет роста его отрицательного заряда при определенной степени модификации несомненно связано со значительным изменением нативной конформации. Последнее выражается и в разрушении детерминантных групп. То, что это заключение справедливо и инактивация белка как антигена в описанном выше примере не обусловлена лишь замещением аминогрупп, подтверждается данными, полученными при антигенном анализе бычьего сывороточного альбумина, в молекуле которого было амидинировано 58 аминогрупп. При таком способе модификации заряд белковой молекулы не изменяется. Не изменяется при этом и гтоксовский радиус. Антигенная структура модифицированного таким способом белка также практически полностью сохраняется.
Убедительные свидетельства существования как в глобулярных, так и в фибриллярных белках антигенных детерминант, структура которых зависит от пространственной конформации молекулы, были получены при сравнении антигенных свойств нативных и денатурированных белков.
В случае восстановления внутрицепьевых дисульфидных связей в молекуле рибонуклеазы в присутствии концентрированной мочевины такой белок утрачивает, по данным физических методов исследования, нативную конформацию. Одновременно происходит разрушение его антигенных детерминант, поскольку денатурированный белок не реагирует с антителами против нативного белка. Однако восстановление двух из четырех дисуль-фидных связей в молекуле рибонуклеазы, выполненное в отсутствие денатурирующих агентов, не сказывается на антигенных свойствах фермента. Аналогичные данные были получены при изучении пепсина, папаина, иммуноглобулина G. Следовательно, сама по себе дисульфидная связь не определяет структуры антигенных детерминант, если при ее разрыве не разрушают стабилизирующих вторичную и третичную структуру нековалентных связей.
Не только третичная, но и четвертичная структура белков определяет их антигенное строение. Детерминанты, в образовании которых участвуют две или три полипептидные цепи, в том числе цепи различного строения, найдены, в частности, в молекуле гемоглобина, коллагена, иммуноглобулина G. При диссоциации молекулы белка на изолированные цепи такие детерминанты разрушаются. В случае спонтанной рекомбинации пептидных цепей с восстановлением активной конформации восстанавливается также структура антигенных детерминант, в образовании которых участвуют две или 'более цепей.
Даже незначительные изменения конформации белка способны повлечь за собой ощутимые изменения его антигенной структуры. Так, удаление тема из молекулы метмиоглобина приводит к появлению свободного от гена белка — апомиоглобина. Последний отличается от нативного белка уменьшением содержания а-спиральных участков с 56—64 до 42—49%. Одновременно происходит небольшое набухание молекулы, увеличение ее асимметрии. Увеличивается чувствительность белка к протео-лизу, доступность для модификации остатков тирозина и гистидина. Эти и другие данные указывают на меньшую конформационную устойчивость апомиоглобина по сравнению с метмиоглобином. Антитела к метмиоглобину имеют низкую степень сродства к апомиоглобину. Если путем добавления гема к апомиоглобину реконструировать молекулу метмиоглобина, восстанавливается также и его антигенная структура.
Вообще спонтанное восстановление конформации денатурированного белка ведет к восстановлению его антигенной структуры. Это продемонстрировано на совершенно различных по степени сложности структурной организации белках, в том числе на таких, как рибонук-леаза и иммуноглобулин G. Тем самым антигенный анализ может служить одним из надежных методов оценки степени ренатурации белка.
Особо следует рассмотреть вопрос о специфичности антител, образующихся при иммунизации денатурированными белками. Они взаимодействуют только с денатурированным белком, причем антитела к одному из денатурированных белков взаимодействуют с другим денатурированным белком. Это наблюдается и в том случае, когда изучаемые белки в нативном виде не имеют антигенного родства. Здесь надо иметь в виду, что, утратив определенную конформацию вследствие денатурации, белок приобретает некоторую другую конформацию, чаще всего хаотического клубка, которая допускает возникновение у разных белков статистически вероятных пространственных структур, мало зависящих от их первичной структуры. Скорее всего именно благодаря этим структурам возникает антигенное родство различных денатурированных белков.
