Антитела и клеточные рецепторы для них
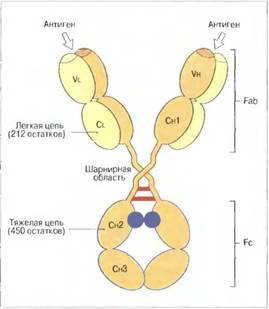
Как установили Хильшманн, Крейг и др., легкие цепи состоят из двух различных областей. С-концевая половина цепи одинакова у легких цепей всех типов; она названа константной, или CL-областью. В то же время Н-концевая половина этой цепи имеет множество вариантов аминокислотной последовательности, из-за чего названа вариабельной, или VL-областью.
Молекулы lgG имеют «типичную» для антител структуру.
В качестве «типичного» антитела можно рассматривать молекулу IgG. В ней имеется две внутрииепочечные днсульфндные связи в каждой легкой цепи — по одной в вариабельной и константной областях — и четыре таких связи в каждой тяжелой цепи, которая вдвое длиннее легкой. Каждая дисульфидная связь замыкает пептидную петлю из 60—70 аминокислотных остатков; при сравнении аминокислотных последовательностей этих петель выявляется удивительно высокая степень их гомологии. В основном поэтому каждая полипептидная цепь иммуноглобулина образует несколько глобулярных доменов с весьма сходной вторичной и третичной структурой.
Пептидная петля, замкнутая дисульфидной связью, — это центральная часть «домена», в котором всего насчитывается примерно 110 аминокислотных остатков. Как в легких, так и в тяжелых цепях первые от Н-конца домены образованы соответственно вариабельными областями Vl и Vh. Тяжелые цепи lgG, IgA н IgD имеют еще три домена — Сн1, Сн2 и Сн8, составляющих константную область. В цепях непосредственно за Сн1 следует один дополнительный домен, поэтому С-концевые домены тяжелых цепей IgM и IgE гомологичны СнЗ-домену IgG.
Модель молекулы IgGl с изображением глобулярных доменов тяжелой и легкой цепей. Обратите внимание на взаимное сближение доменов СнЗ и разделение доменов Сн2, между которыми расположены углеводные компоненты. На этом рисунке дисульфидные связи между Н- и L-цепями не показаны.
По данным рентгеноструктурного анализа удалось реконструировать б-углеродный скелет и построить компьютерные модели целых молекул IgG. Модельные IgG имеют вид Y- и Т-образных структур, и аналогичные формы IgG выявлены с помощью электронной микроскопии.
В Fab-области молекулы иммуноглобулина гомологичные домены легких и тяжелых цепей располагаются парами; СуЗ-домены двух тяжелых цепей также образуют пару, но Су2-домены разделены углеводными компонентами.
Несмотря на структурное сходство гомологичных доменов, междоменные взаимодействия в разных парах существенно различаются. Например, вариабельные домены контактируют друг с другом слоями, состоящими из трех сегментов цепи, а константные — слоями из четырех сегментов. Модель молекулы IgGl в общем адекватно отражает структуру элементарных единиц в составе иммуноглобулинов всех изотипов, однако каждый класс и подкласс имеет свои характерные отличия в деталях строения.
IgG. Четыре подкласса IgG человека лишь слегка различаются по аминокислотной последовательности тяжелых цепей. Этими различиями, относящимися в основном к шарнирной области, обусловлены изотипические вариации расположения и числа межцепочечных дисульфидных связей. Из четырех подклассов наиболее выраженной структурной особенностью — удлиненной шарнирной областью — обладает lgG3, чем объясняется его более высокая мол. масса и, отчасти, повышенная биологическая активность.
IgM. У человека IgM обычно обнаруживается в виде пентамера основной четырехцепочечной структурной единицы. Отличие его м-цепи от г-цепей IgG состоит в иной аминокислотной последовательности и наличии дополнительного константного домена с С-концевым пептидом из 18 аминокислотных остатков. Субединицы пентамера соединены дисульфидными связями между С^З-доменами и, вероятно, между С-концевыми пептидами. По данным электронной микроскопии молекула IgM имеет плотно сложенный центр, от которого расходятся пять ветвей.
На микрофотографиях антитела IgM, связавшиеся с бактериальным жгутиком, видны в «крабовидной» конфигурации. Такая форма молекулы IgM свидетельствует о том, что тяжелые цепи в области между Cμ2 и CμЗ могут легко изгибаться, хотя по структуре эта область не гомологична шарнирной области IgG. Взаимное расположение разных частей молекулы IgM, принявшей «крабовидную» конфигурацию, по-видимому, связано с активацией ею комплемента.
Молекулу IgM характеризуют еще два свойства: многочисленные присоединенные к м-цепи олигосахариды и добавочная пептидная J-цепь, которая предположительно принимает участие в полимеризации мономерных единиц, предшествующей выходу IgM из синтезирующей его клетки. J-цепь представляет собой полипептид из 137 аминокислотных остатков, образующий домен иммуноглобулинового типа. Каждая молекула IgM содержит только одну J-цепь. Она соединена дисульфидными связями с С-концевыми. состоящими из 18 аминокислотных остатков пептидами тяжелых цепей отдельных мономеров. Имеется наблюдение, что в клетках, секретирующих IgM преимущественно в форме гексамера, отсутствуют свободные J-цепи.
IgA. Состоящая из 472 аминокислотных остатков б-цепь свертывается с образованием четырех доменов: Vh, Ccd, Сос2 и СосЗ. Аналогично IgM тяжелая цепь IgA содержит дополнительный С-концевой пептид из 18 аминокислотных остатков с остатком цнстеина в предпоследней позиции. Этот остаток способен ковалентно взаимодействовать с J-цепью, соединяющей две молекулы с образованием димера. На электронных микрофотографиях димеры IgA выглядят как двойные Х-формы, что свидетельствует о соединении двух мономерных субъединиц конец-в-конец и об участии в этом соединении С-концевых областей СаЗ.
Секреторный IgA представлен главным образом димерной формой с коэффициентом седиментации 11S. Полностью собранная молекула состоит из двух мономеров IgA. одного секреторного компонента и одной J-цепи. Как все эти пептидные цепи связаны между собой, до конца не ясно. В противоположность J-цепи секреторный компонент синтезируется не в плазматических, а в эпителиальных клетках. Молекулы IgA, удерживаемые в димерной конфигурации J-цепью и секретируемые субэпителиальными плазматическими клетками слизистых оболочек, при прохождении через эпителиальный покров активно связывают секреторный компонент. Он способствует доставке антител slgA в выделения организма, а также защищает эти антитела от протеолиза.
Преобладающий подкласс IgA, как в сыворотке, так и в выделениях организма, — это IgAl. Однако в просвете толстой кишки около 60% IgA составляет подкласс lgA2. Многие бактерии в микрофлоре верхних дыхательных путей, приспособленные к условиям обитания, выделяют протеазы, расщепляющие IgAl.
IgD. К IgD относится меньше 1% иммуноглобулинов сыворотки. Этот белок гораздо более чувствителен к протеолизу, чем IgGI, IgG2, IgA или IgM и, кроме того, проявляет тенденцию к спонтайному протеолнзу. По-видимому, его д-цепи удерживаются вместе всего одной дисульфидной связью и соединены с большим количеством углеводых цепей.
IgE. Молекула IgE состоит из более крупных е-цепей, содержащих большее число аминокислотных остатков и образующих пять доменов.
