Белки клеточного цикла в отделах мозга сусликов citellus undulatus на разных стадиях гибернационного цикла
1.2 Клеточный цикл
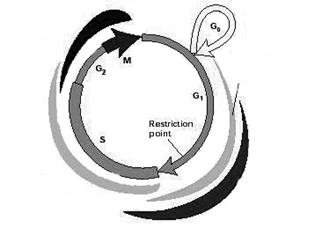
В норме клеточный цикл - это последовательность событий, приводящих к делению исходной клетки на две дочерние. Его подразделяют на четыре фазы (или стадии): S фаза (в ней происходит репликация ДНК) и М фаза (фаза митоза) разделены промежутками – это фазы G1 и G2. Покоящиеся клетки находятся в G0 фазе [30 ].
Для нервных клеток млекопитающих показано, что повторное вступление клетки в клеточный цикл зависит от внеклеточных сигналов. К ним относят митогенные стимулы (например, факторы роста FGF и EGF, тромбин, сыворотка) и факторы дифференцировки (цитокины, стрессорные влияния на клетку – такие как ультрафиолетовое излучение, или повреждающие ДНК воздействия) [ 31 ] . Эти сигналы осуществляют свое влияние через последовательную экспрессию, активацию и деактивацию так называемых белков клеточного цикла - комплексов циклинов (Cn) с циклин-зависимыми протеинкиназами (cdk). Cn/cdk комплексы обеспечивают развитие клеточного цикла, и тонко регулируются множеством механизмов: транскрипцией, фосфорилированием, протеолизом, а также активностью ингибиторов циклин-зависимых протеинкиназ (i-cdk). В ходе онтогенеза экспрессия и активное взаимодействие циклинов, Cn/cdk комплексов и i-cdk сопровождается выходом клетки из клеточного цикла, приводящим к дифференцировке. Во взрослом организме эти агенты участвуют в контроле клеточного цикла, а i-cdk останавливают пролиферацию нейронов, предотвращая появление опухолей.
Выход клетки из покоящегося состояния (фазы G0) и запуск фазы G1 обеспечивается так: митогенные стимулы активируют митоген-зависимые протеинкиназы (МАРК) и экспрессию циклина D (CnD) (рис. 1):
|
|
|
| |
|
| |
Рис. 1. Схема клеточного цикла.
Далее происходит образование комплекса CnD/cdk4 (или cdk6), который обеспечивает переход клетки из фазы G0 в фазу G1. Если в этот период экспрессия CnD подавляется (воздействием МАРК, активированных, например, в результате клеточного стресса), то происходит остановка клеточного цикла на стадии G1. В начале фазы G1 в клетке появляется CnE (деактивация которого также приводит к остановке клеточного цикла в G1 фазе). Для осуществления перехода в следующую фазу цикла – S фазу, необходимо образование CnE/cdk2 комплекса. В этой же G1 фазе начинает экспрессироваться CnA; и комплекс CnA/cdk2 обеспечивает вступление клетки в следующую (после стадии S) фазу G2 клеточного цикла. Недостаток CnA влечет за собой остановку клеточного цикла в G2. CnB, присутствующий в клетке в течение всей интерфазы, активируется в самом конце фазы G2 и образует комплекс с cdс2, необходимый для начала последней стадии цикла - М фазы. Деактивация CnB приводит к остановке клеточного цикла в фазе G2 [ 12, 33 ].
1.3 Ишемический инсульт и нейрогенез
Ишемический инсульт (инфаркт мозга) развивается при значительном уменьшении мозгового кровотока. На стадии реперфузии, когда мозговой кровоток восстанавливается, происходит интенсификация окислительного стресса, который характеризуется как дисбаланс между продукцией активных форм кислорода и емкостью антиоксидантной защиты. В результате окислительного стресса происходит повреждение липидов, белков и нуклеиновых кислот и гибель клеток мозга по некротическому и/или апоптотическому типу.
Гибернация является уникальным физиологичеким состоянием, при котором происходит снижение метаболизма и температуры тела, обеспечивающие выживание в период дефицита пищи. Значительная степень нейропротекции при гибернации обусловливается комбинацией факторов, играющих важную роль в защите мозга от повреждения при кардинальном изменении мозгового кровотока во время спячки и после пробуждения. Адгезия нейтрофилов и инфильтрация макрофагов в место повреждения стимулируют цитотоксичекие реакции при ишемии мозга. Лейкоцитопения, снижение продукции антител и повышение антиоксидантной защиты могут защищать нейроны от повреждения при гибернации. На моделях фокальной ишемии-реперфузии показано, что ингибирование синтеза белка, которое также наблюдается при гибернации, обладает нейропротекторным действием [ 22 ].
Известно, что в мозге экспериментальных животных после ишемии усиливается нейрогенез, который частично компенсирует нейродегенеративные изменения. Показано, что в моделях на грызунах инсульт, вызванный окклюзией средней мозговой артерии (ОСМА), запускает усиленный нейрогенез в поврежденном стриатуме и неповрежденном гиппокампе молодых грызунов. В результате экспериментов на животных старшего возраста было показано, что у молодых и старых крыс происходит одинаковое увеличение числа новообразованных нейронов стриатума после инсульта, несмотря на то что базальная пролиферация клеток в субвентрикулярной зоне у старых крыс была снижена [2]. Напротив, число новообразованных после инсульта гранулярных клеток и базальный нейрогенез в субгранулярной зоне зубчатой извилины были ниже у старых животных по сравнению с молодыми. Кроме того, у старых крыс в зубчатой извилине была ослаблена способность новообразованных клеток дифференцироваться в нейроны. Но, тем не менее, величина стриарного постинсультного нейрогенеза сопоставима у молодых и старых животных, что указывает на функционирование этого механизма восстановления также и в пожилом возрасте.
Таким образом, механизмы нейропротекции при гибернации связаны с гипотермией, лейкоцитопенией, снижением синтеза белка, повышением антиоксидантного статуса клеток мозга и , по-видимому, могут включать в себя также и изменение пролиферации клеток мозга ни только в направлении образования новых нейронов, как показано на моделях ишемического повреждения мозга, но и в пролиферации эндотелиальных клеток сосудов мозга и клеток глии [ 24 ].
