Биохимия нуклеиновых кислот
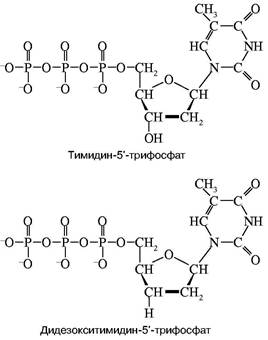
Рис. 1. Структуры тимидин-5'-трифосфата и его дидезоксианалога
рибонуклеотид, у которого эта ОН-группа отсутствует. Его можно обозначить в представленном случае символом ddT. С какой-то вероятностью ДНК-полимераза узнает и присоединит к растущей цепи очень похожий ddT вместо dT. Так как синтез идет в строгом соответствии с принципом компле-ментарности, то это произойдет напротив той точки матричной ДНК, где находится комплементарный dA. Но из-за отсутствия у ddT ОН-группы эта цепочка не сможет расти дальше, произойдет обрыв цепи. Обрыв с определенной вероятностью может произойти в любой точке напротив dA. Таким образом, получится смесь новосинтезированных цепей разной протяженности, причем длины (числа нук-леотидных остатков) всех этих цепей точно соответствуют номерам остатков dA матрицы. Следовательно, в таком эксперименте определяются точки расположения всех остатков dA в исследуемой ДНК. Если три аналогичных эксперимента провести со смесями, содержащими примеси других диде-зоксинуклеотидов: ddA, ddC и ddG, то аналогично будут расставлены по номерам все остальные три нуклеотида на исследуемой ДНК. Разделить же полученные смеси по длинам не представляет труда с помощью электрофореза — метода, основанного на перемещении заряженных молекул под действием постоянного электрического поля. Дело в том, что каждый остаток нуклеотида содержит остаток фосфорной кислоты, который несет отрицательный заряд. Поэтому, будучи помещены в электрическое поле, фрагменты разной длины будут перемещаться к аноду с разными скоростями. Так как электрофорез обычно проводят в очень вязкой среде (геле), то эта среда оказывает сопротивление перемещению фрагментов, тем большее, чем больше размером фрагмент. Этот фактор пересиливает действие поля, поэтому, чем длиннее фрагмент, тем медленнее он двигается, но все они располагаются в порядке, соответствующем их длинам. Остается только "увидеть" место каждого фрагмента. До сих пор для этой цели чаще всего используют радиоактивную метку: в нуклеотиды, из которых синтезируется новая цепь, вводят радиоактивный фосфор. Поэтому после окончания гель-электрофореза гель прикладывают к рентгеновской пленке и на месте нахождения фрагментов после проявления радиоавтографа появляются темные пятна. На рис. 2 схематично показаны такой радиоавтограф и читаемая с него последовательность маленького кусочка ДНК.
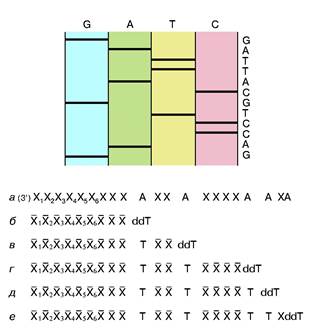
Рис. 2. Схема метода Сенгера и схематичное представление фрагмента радиоавтографа геля с соответствующей ему последовательностью нук-леотидов.Хи X -произвольныекомплементарные остатки нуклеотидов. Пронумерованы индексами остатки, входившие в состав праймера. dA - остатки дезоксиаденозинового нуклеотида в составе анализируемой ДНК. dT и ddT - остатки тимидин монофосфата и дидезокситимидин монофосфата, включившиеся в новые цепи ДНК, полученные при репликации с помощью ДНК-полимеразы
Следует отметить, что метод Сенгера, равно как и метод Максама—Гилберта, совершившие революцию в изучении структуры ДНК, оказался успешным благодаря нарушению основного канона аналитической химии, который можно сформулировать так: если нельзя напрямую определить структуру некоторой молекулы, нужно ее количественно превратить в другую молекулу, строение которой известно. На этом принципе построен и замечательный метод Эдмана для установления последовательности аминокислот в полипептидах (фрагментах белков). Автор нашел химическую реакцию, которая позволяет отщепить с одного, определенного конца полипептида один остаток аминокислоты, превратив его в так называемый тиогидантоин и не разрушая при этом остальную цепочку. Разным аминокислотам соответствуют разные тиогидантоины, так что легко определить, какая именно из 20 аминокислот, входящих в состав белков, была отщеплена. Укороченный на одну аминокислоту полипептид может быть повторно использован для определения природы следующего аминокислотного остатка. Однако каждый найденный аминокислотный остаток — результат отдельной процедуры, и таким путем в лучших случаях удается проделать несколько десятков шагов. В методе Сенгера анализируется сложная смесь продуктов репликации, так что с одного геля (точнее, с четырех дорожек одного геля) сразу расставляются по своим местам сотни нуклеотид-ных остатков.
Успешно развиты и методы химического синтеза больших фрагментов нуклеиновых кислот — олиго-нуклеотидов. Как и в случае секвенирования, все началось с чрезвычайно трудоемких методов. Разработав и применив на практике эти методы, американский ученый Гобинд Корана в 1970 году завершил синтез ДНК, кодирующей последовательность одной из тРНК дрожжей, специфичной к аминокислоте аланину. Однако из процедуры, требовавшей многолетнего труда большого числа специалистов высшей экспериментальной квалификации, в рутинный метод, выполняемый на специальных автоматических синтезаторах, синтез превратился существенно позднее. Это было связано как с изменением химических процессов, положенных в основу последовательного присоединения к растущей цепи необходимых нуклеотидов, так и в огромной мере с введением в практику так называемого твердофазного синтеза, общий принцип которого был предложен американским ученым Робертом Мер-рифилдом для синтеза белков из аминокислот.
Как в белках, так и в нуклеиновых кислотах связи между мономерными звеньями, сколько бы их ни было, идентичны. В нуклеиновых кислотах это всегда связь между остатком фосфорной кислоты, принадлежащей одному звену мономера, и гидро-ксильной группой (ОН) соседнего мономера. Чтобы построить, например, фрагмент нуклеиновой кислоты длиной в 100 нуклеотидов, нужно последовательно 99 раз осуществить реакцию образования этой связи, поочередно вводя в реакцию один мономер за другим. Сегодня проблемы образования такой связи в химии, можно сказать, не существует. Вопрос в том, чтобы каждый раз проводить эту реакцию как можно более количественно и с минимальным накоплением ненужных (побочных) вществ. Химик считает, что, проведя реакцию с выходом 80%, он имеет неплохой результат. Но общий выход стостадийного процесса при выходе 80% на каждую стадию составит 0,8100 = 10~9, то есть одну миллиардную часть от введенного в реакцию первого нуклеотида. Очевидно, что такой выход не может быть основой для прогрессивной технологии. Между тем, по крайней мере частично, неколичественные выходы происходят от того, что по химическим традициям при проведении реакции в несколько стадий нужно после каждой стадии выделить полученный продукт, очистить его от не вступивших в химическую реакцию реагентов, от других примесей и только потом приступать к следующей стадии. Потери, причем вполне ощутимые, на каждой стадии неизбежны.
Меррифилд предложил отказаться от этой классической химической традиции. Согласно его идее, первое звено создаваемой цепи полимера прочно, до самого конца синтеза, закрепляется химической связью на твердом веществе-носителе, который помещается в специальную трубку-реактор (колонку). Через реактор пропускается второй мономер, причем в достаточном избытке, чтобы превращение закрепленного мономера было как можно более полным. Затем избыток второго мономера и все вспомогательные вещества, нужные для образования химической связи между мономерами, отмываются пропусканием через реактор подходящего растворителя. Заодно отмываются и побочные вещества, по крайней мере те, которые не связаны с носителем. После этого приступают к присоединению третьего звена. Процедуру можно повторять много раз, хотя, конечно, и не до бесконечности — какие-то потери и загрязнения неизбежны. Ясно, что такая процедура легко поддается автоматизации. Синтезатор олиго-нуклеотидов (иногда его называют ген-синтезатором) имеет несколько сосудов, содержащих отдельные мономеры, вспомогательные вещества, нужные для синтеза, и растворители для промежуточных промывок реактора. Все эти вещества подаются поочередно в реактор, содержащий носитель и растущую на нем полимерную цепь с помощью насоса, который выбирает каждый раз нужный сосуд по введенной в прибор программе. В программу вводится и та последовательность, которую следует синтезировать. Этим задается структура будущего продукта. Остается только по окончании синтеза разрушить химическую связь, с помощью которой первое мономерное звено было закреплено на носителе, и провести очистку синтезированного продукта от неизбежно накопившихся примесей. В умелых руках на надежно работающих ген-синтезаторах удается получать фрагменты длиной до ста нуклеотидов и более. Конечно же, биологически интересные гены значительно длиннее. Однако уже на заре становления искусственного синтеза нуклеиновых кислот Корана разработал способ соединения достаточно длинных олигонуклеотидов между собой с помощью существующего у всех живых организмов фермента ДНК-лигазы. Так что в настоящее время синтез генов является хотя и трудоемкой, но вполне доступной процедурой.
