Возможности ионообменной хроматографии
Главным образом потому, что фракционируемые вещества выходят из колонки в органическом растворителе, в то время, как для подавляющего большинства биологических веществ нормальная среда - водная.
В отличие от этого, предложенный позднее вариант так называемой "обращенной" или "обратнофазовой" распределительной хроматографии оказался весьма продуктивным. Здесь связывание молекул в неподвижной фазе происходит за счет их, пусть даже не ярко выраженных, но существующих гидрофобных свойств. (Например, наличия гидрофобных участков на поверхности белковой глобулы).
В неподвижной фазе создаются условия для хорошо выраженного гидрофобного взаимодействия. Обычно не с жидкостью, находящейся внутри гранул, поскольку органический растворитель трудно удержать внутри обычной гидрофильной матрицы (он ее не смачивает).
Гидрофобную среду создают либо на поверхности самой матрицы, заставляя частично гидрофобные молекулы в водной среде "прилипать" к этой поверхности, либо в тонкой пленке сильно гидрофобного растворителя, надежно связанного с матрицей.
Гидрофобизированные матрицы сефарозы
Первый вариант представлен, в частности, модифицированными матрицами на основе хорошо знакомой нам сефарозы. По множеству ОН-групп нитей агарозы ковалентной связью присоединяют гидрофобные радикалы.
Соответственно модифицированные матрицы именуются: "октил-сефароза", "октилдецил-сефароза" и "фенил-сефа-роза". Присоединенные радикалы создают сильно гидрофобную среду на поверхности самой сефарозной матрицы.
Разделять белки по силе гидрофобного взаимодействия с этой средой можно путем простой изократической элюции водным буфером. Однако разделение можно ускорить и улучшить, если вести элюцию линейным градиентом слабого раствора NaCI (0,02-0,3М) в буфере. Дело в том, что в слабых солевых растворах белки растворяются лучше, чем в воде.
Улучшение растворимости белковых молекул в элюенте способствует отрыву белков от гидрофобизированной поверхности матрицы, а следовательно, и извлечению их из неподвижной фазы.
Любопытно, что на той же самой гидрофобизированной матрице те же самые белки можно разделять обратным - снижающимся градиентом концентрации соли. В очень концентрированных водных растворах соли, в частности сульфата аммония, растворимость белков падает до нуля.
Этим можно воспользоваться для обеспечения путем элюции снижающимся градиентом сульфата аммония (например.1-0,5М) постепенного увеличения растворимости белков в элюенте, что приведет к тем же результатам, что и в предыдущем случае.
Система ХОФ-5
Другой вариант распределительной хроматографии в обращенных фазах под сокращенным наименованием ХОФ-5 (RPC-5) был одно время очень популярен и, кажется, сохранил свое значение и сейчас.
В нем используется сильно гидрофобная жидкость, тонкой пленкой надежно обволакивающая нити гидрофобизированной матрицы, например липофильной модификации сефадекса с торговым названием "Сефадекс LH-20".
Пленку образует жидкость со сложным химическим наименованием - трикаприлилмонометиламмоний хлорид (торговое название "Адоген 464"). Из ее химической формулы: видно, что молекулы этой жидкости содержат обширную алифатическую оболочку, окружающую атом азота, несущего положительный заряд.
Система ХОФ-5 оказалась весьма эффективной для фракционирования нуклеиновых кислот. Нуклеиновые основания представляют собой совокупность замкнутых циклов с сопряженными связями и потому обладают высокой степенью ароматической гидрофобности, что и обеспечивает их склонность к растворению в гидрофобной пленке.
По-видимому, такому растворению способствует и притяжение отрицательно заряженных фосфатов нуклеиновой кислоты к положительно заряженным атомам азота в адогене 464.
Элюцию колонок ХОФ-5 ведут относительно пологим возрастающим градиентом концентрации NaCl. Присутствие соли блокирует названную электростатическую связь азот-фосфор, облегчая выход ДНК из гидрофобной пленки в окружающую ее водно-солевую среду.
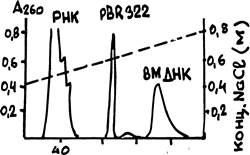
В качестве примера на рис.59 показан результата хроматографической очистки плазмиды pBR322 от окружающих ее в лизате бактерии РНК и высокомолекулярной ДНК (по данным фирмы BRL, 1981). Пунктирная линия на рисунке обозначает градиент концентрации NaCl.
Особенно часто обратнофазовую распределительную хроматографию используют для разделения низкомолекулярных объектов (аминокислот, пептидов, нуклеотидов и пр.) при высоком давлении (ЖХВД). Конкурентную элюцию в большинстве случает ведут градиентом относительно слабо гидрофобных органических растворителей: метанола, этанола, пропанола, ацетонитрила или тетрагидроф урана (ТГФ).
Хотя ранее было решено, что мы оставляем в стороне ЖХВД, но здесь имеет смысл о ней упомянуть, чтобы прояснить одну ранее оставшуюся без разъяснения ситуацию. Дело в том, что именно с помощью такого вида хроматографии осуществляют идентификацию аминокислот при секвенировании белков по методу Эрдмана.
Секвенирование ведется путем последовательного отщепления "сложных и весьма гидрофобных производных аминокислот". Здесь я могу привести их общее химическое наименование ("фенилтиогидантоиновые производные" - ФТГ) с одной только целью - указать на начало этого наименования, где фигурирует фенил - радикал фенола. Это и есть причина гидрофобности.
На Рис.60 показан хроматографический профиль разделения смеси ФТГ-производных 20-ти аминокислот методом ЖХВД на колонке, где на основе силикагеля закреплены алифатические 18-ти членные радикалы октилдецила. По сути дела это тот же самый первый вариант твердой гидрофобной матрицы, который
Аффинная хроматография. Общая характеристика метода
Это - самый сложный, тонкий и, пожалуй, самый капризный метод хроматографии. Но зато, в случае успеха, - фантастически эффективный! С его помощью в одной хроматографической операции удается полностью очистить вещество, представленное в смеси с другими компонентами ничтожной долей - порядка нескольких сотых процента.
Аффинный означает родственный (от латинского af finis) или, точнее, обладающий сродством. Аффинная связь в нашем случае подразумевает биоспецифическое взаимодействие, отличающееся исключительной избирательностью. Такая избирательность лежит в основе множества строго детерминированных процессов, протекающих в организме.
В качестве примеров можно назвать взаимодействия между ферментами и их субстратами или ингибиторами, между гормонами и их рецепторами, между антигенами и антителами к ним, между многими малыми молекулами, например, витаминами и специфическими транспортными белками, доставляющими их в клетку.
Наконец, между нуклеиновыми кислотами и специфическими белками, управляющими реализацией их функций: редупликацией, транскрипцией и трансляцией.
Любой из компонентов названных и им подобных биоспецифических пар можно надежно закрепить на хроматографической матрице в качестве так называемого "лиганда". С его помощью второй партнер такой пары может быть извлечен из смеси с другими, не комплементарными лиганду веществами и временно задержан на матрице в составе биоспецифического (аффинного) комплекса.
