Гипотеза мира РНК
Данные рентгеноструктурного анализа свидетельствуют о сходстве пространственных структур домена PIWI и РНКазы Н. Очевидно, именно домен PIWI обусловливает эндонуклеазную активность всего комплекса. Предполагают, что функция РАZ состоит в распознавании и связывании siРНК, имеющих два неспаренных нуклеотида на З'-конце. RISC, связанный с двухцепочечной siРНК, неактивен. Для его активации необходимо расхождение цепей siРНК, катализируемое АТР-зависимой хеликазой .
Показано, что активный RISC содержит только антисмысловую цепь siРНК, комплементарную участку мРНК-мишени, что позволяет ему распознавать и связываться с последовательностью-мишенью на мРНК, комплементарной этой цепи. После этого входящая в состав комплекса RISC эндорибонуклеаза расщепляет молекулу мРНК-мишени на фрагменты длиной от 21 до 23 н
У растений и червей может происходить амплификация siРНК. За это отвечает РНК-зависимая РНК-полимераза (RdRp). Используя в качестве затравки антисмысловую цепь siРНК, а в качестве матрицы - молекулу мРНК, этот фермент синтезирует новые дцРНК, которые затем превращаются в siРНК при участии Dicer. У этих организмов интерференции РНК имеет системный эффект, как следствие передачи сигнала из клетки в клетку или его доставки во все ткани организма. Такое явление называется системной супрессией. Передача дцРНК или siРНК у растений может происходить по цитоплазматическим мостикам из клетки в клетку или по системе сосудов.
Таким образом механизм интерференции РНК следующий: на первом этапе длинная дцРНК нарезается белком Dicer с образованием siРНК. Эта реакция протекает с использованием энергии АТР. Далее двухцепочечная siРНК связывается с группой белков, формируя нуклеопротеидный комплекс RISC (Этап 2). Один из его компонентов - АТР-зависимая хеликаза, которая раскручивает дуплекс siРНК. В результате в составе RISC остается только антисмысловая цепь siРНК (Этап 3). Такой модифицированный комплекс функционально активен. Активированный RISC распознает и связывает мРНК-мишень за счет комплементарного спаривания с ней антисмысловой цепи siРНК (Этап 4). Далее входящий в состав комплекса белок Аgо2 разрезает молекулу мРНК (Этап 5). У растений и нематод существует механизм амплификации siРНК. При этом РНК-зависимая РНК-полимераза синтезирует дцРНК на матрице мРНК, используя в качестве затравки антисмысловую цепь siРНК (Дополнительный этап). Новосинтезированные дцРНК разрезаются при участии Dicer, давая начало новому пулу siРНК [5].
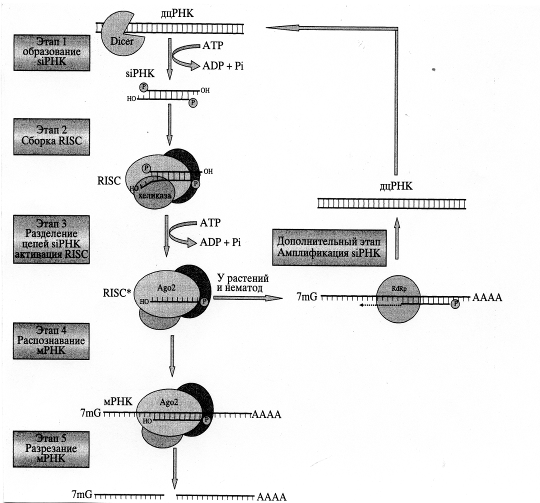
Рис. 6. Механизм интерференции РНК
I.5 Структура РНК-содержащих стрессовых гранул
При некоторых видах стресса например, при тепловом шоке, воздействии УФ-офлучения, энергетическом голодании, окислительном стрессе в цитоплазме клеток возникают стрессовые гранулы – плотные РНП-содержащие цитоплазматические тельца. В стрессовые гранулы при стрессе включается не вся клеточная мРНК: часть ее продолжает сохранять диффузное распределение в цитоплазме. По-видимому, для инкорпорации мРНК в стрессовые гранулы не нужны какие-либо специфические сигнальные последовательности, поскольку репортерная мРНК, не несущая известных сигнальных последовательностей, включается в состав стрессовых гранул. Скорее всего, специфические сигнальные последовательности нужны для исключения РНК из стрессовых гранул. Возможно, что из стрессовых гранул выводятся как раз те РНК, трансляция которых необходима при стрессе.
В составе стрессовых гранул выявлены различные РНК-связывающие белки, связывающие как большинство цитоплазматических мРНК, так и специфические последовательности в определенных мРНК. К первой группе можно отнести РАВР (поли(А)-связывающий белок), FMRP, основной белок мРНП YВ-1. Белок Staufen, входящий в состав транспортирующихся мРНП, входит и в состав стрессовых гранул в олигодендроцитах, вероятно, как «неспецифический» РНК-связывающий белок. Ко второй группе относятся различные белки, специфически связывающие АU-богатые последовательности (АRE), содержащиеся в З'-концевой некодирующей области некоторых, обычно короткоживущих, мРНК. Из этой группы белков локализация в стрессовых гранулах была показана для тристетрапролина (ТТР), эндорибонуклеазы G3ВР, белков НuR, ВRF1, ТIА-1 и ТIAR.
Структурная основа стрессовых гранул не изучена, но весьма вероятно, что она состоит из прионоподобного конгломерата РНК-связывающего белка ТIА-1, обычно локализованного в ядре.
Одной из первых адаптивных реакций при стрессовых воздействиях на эукариотическую клетку является изменение в системе трансляции. С одной стороны, происходит общее падение уровня синтеза белка в клетке, а с другой – активация трансляции некоторых видов мРНК. Образование стрессовых гранул происходит одновременно с общим снижением синтеза белка. В настоящий момент принято считать, что именно ингибирование синтеза белка на стадии инициации трансляции вызывает появление стрессовых гранул в цитоплазме. В случае окислительного стресса, вызванного арсенатом, образование стрессовых гранул зависит от ингибирования инициации трансляции за счет фосфорилирования фактора еIF2. Фосфорилирование α-субъединицы еIF2 по Sег-52 приводит к тому, что еIF2 прочно связывается с фактором еIF2В и блокирует замену GDР на GТР. В результате в клетке происходит резкое уменьшение количества активной формы фактора еIF2-GТР и, соответственно, снижение уровня тройственного комплекса (еIF2-тРНКМеt-GТР). В такой ситуации формируются неканонические инициаторные комплексы, которые не могут перейти к элонгации трансляции.
Каков бы ни был механизм, запускающий образование стрессовых гранул, при стрессорном воздействии первоначально диффузное распределение мРНП сменяется на локализацию в отдельных точках цитоплазмы – стрессовых гранулах. Для подобного изменения локализации необходимы значительные перемещения индивидуальных мРНП. При этом необходимо отметить, что размер мРНП достаточно велик и свободная диффузия частиц подобного размера в цитоплазме ограничена. Преодоление ограничения диффузии в клетке происходит за счет активного транспорта по цитоскелету – микротрубочкам или актиновым филаментам. Разрушение актиновых филаментов не ингибирует образование стрессовых гранул, в отличие от нарушения системы микротрубочек. Вызванная действием фармакологических агентов деполимеризация микротрубочек в клетке подавляет образование стрессовых гранул. Восстановление микротрубочек на фоне окислительного стресса вызывает возникновение в такой клетке стрессовых гранул. Скорее всего, роль микротрубочек в формировании стрессовых гранул заключается в активном транспорте мРНП. Стрессовые гранулы способны перемещаться по клетке, и их движение подавляется при разрушении микротрубочек. Компоненты стрессовых гранул обмениваются с цитоплазмой, и этот обмен также значительно замедляется после разборки микротрубочек. Таким образом, микротрубочки необходимы для пространственного перемещения компонентов стрессовых гранул (поли(А)-связывающего белка, фактора eIF2, белка TIA-1).
