Группа пневмовирусов
2. После фиксации в течение 30 мин монослой дважды промывают PBS и добавляют 10 капель 1% -ного раствора четы-рехокиси осмия.
3. Через 15 мин монослой еще 2 раза промывают PBS, снимают клетки со стекла и суспендируют их в 2 мл PBS.
4. Клетки осаждают центрифугированием и дегидратируют, последовательно суспендируя в растворах с возрастающей концентрацией этанола; в каждом растворе клетки инкубируют 5 мин; при необходимости их можно выдержать в течение ночи в 70% -ном этаноле. После инкубации в 90% -ном этаноле клетки дважды по 15 мин обрабатывают 100% -ным этанолом.
5. Этанол заменяют на смесь этанола и окиси пропилена.
6. Через 15 мин смесь этанол-окись пропилена заменяют на свежую, инкубируют суспензию еще 30 мин, после этого ресуспендируют клетки в смеси этанол-окись пропилена-среда EPON, а затем в среде EPON 1 ч.
7. Компактный осадок клеток наносят на небольшой объем среды EPON в капсуле ВЕЕМ и, заполнив капсулу средой EPON, инкубируют их 48 ч при 60 °С для полимеризации. После этого заключенные в капсулу клетки готовы для приготовления срезов стандартным способом на ультрамикротоме.
8. Тонкие срезы располагают на необработанных сеточках для электронной микроскопии и через 24 ч окрашивают 5 мин,, помещая сеточки препаратами вниз в каплю насыщенного раствора уранилацетата в метаноле.
9. Сеточки промывают дистиллированной водой и сушат на листе фильтровальной бумаги.
10. На срез наносят каплю 0,1 М раствора NaOH и помещают сеточку срезом вниз на 5 мин в каплю раствора ацетата свинца. Сеточки промывают и сушат на листе фильтровальной бумаги, после этого они готовы к электронно-микроскопическому исследованию.
3.3.3 Сканирующая электронная микроскопия
Для подготовки клеток к сканирующей электронной микроскопии применяют следующий метод.
1. Клетки, образующие неплотный монослой на покровных стеклах, фиксируют 1-2 ч 2,5% -ным раствором глутарового альдегида в фосфатном буфере.
2. Стекла помещают на 1 ч в 1% -ный раствор четырехокиси осмия в фосфатном буфере.
3. Клетки дегидратируют, последовательно помещая стекла в 30, 50, 70, 90 и 100% -ный этанол, а затем на 15 мин в смесь этанола с ацетоном.
4. Стекла дважды обрабатывают 100% -ным ацетоном и сушат С02 в критической точке, используя аппарат для сушки фирмы Polaran Equipment Ltd., Watford, Herts или другой аналогичный прибор.
5. Покровные стекла фиксируют на алюминиевых подложках с помощью клея "Electrocday 915" и покрывают золотом с помощью диодного напылителя Polaron Е5000 или другой аналогичной системы. Подготовленные таким образом препараты можно исследовать методом сканирующей электронной микроскопии.
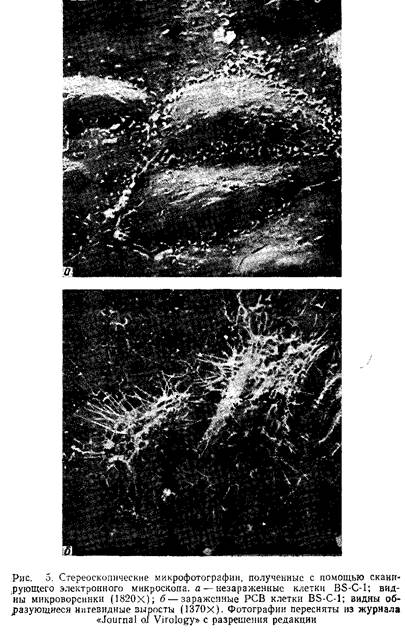
На рис.5 представлена фотография зараженных пневмо-вирусом клеток, выполненная с помощью сканирующей электронной микроскопии. Обратите внимание на длинные выросты инфицированных клеток.
3.3.4 Локализация и количественное определение вирусных антигенов по связыванию стафилококков
Клетки Staphylococcus aureus с помощью поверхностного А-белка связываются с Fc-фрагментами иммуноглобулинов. Этот эффект можно использовать для исследования пространственной локализации вирусного антигена на плазматической мембране зараженных клеток после их обработки противовирусной сывороткой. Стафилококки более удобны, чем покрытые А-белком шарики латекса, полиметил-метакрилата или полистирола, в связи с легкостью получения бактерий и одинаковым диаметром всех бактериальных клеток (около 1 мкм). На поверхности клеток, зараженных многими вирусами, стафилококки распределяются равномерно, но в случае пневмовирусов они специфически связываются с нитевидными выростами, образование которых является уникальной особенностью зараженных этими вирусами клеток. Связывание стафилококков высокоспецифично и подтверждает результаты иммунофлуоресцентного окрашивания, которые свидетельствуют о том, что вирусные антигены на поверхности зараженных клеток локализованы преимущественно в составе нитевидных структур.
Связывание стафилококков с поверхностью зараженных клеток проводят по следующей методике.
1. Клетки выращивают на покровных стеклах до образования монослоя и заражают вирусом. Лучше всего использовать клетки почки кенгуровой крысы, поскольку они высокочувствительны к пневмовирусам и не имеют поверхностных выростов.
2. Зараженные клетки инкубируют в поддерживающей среде, промывают PBS для полного удаления входящей в состав среды сыворотки, затем фиксируют 10-15 мин 2,5% -ным раствором глутарового альдегида в PBS при комнатной температуре.
3. Клетки обрабатывают противовирусной сывороткой 1 ч при 37 °С.
4. Антисыворотку удаляют, тщательно промывая клетки PBS. К клеткам добавляют суспензию aureus, штамм Cowan, приготовленную по методу Прингла и Парри, или коммерческий препарат стафилококков и инкубируют 5 мин при 37 °С.
5. Несвязавшиеся стафилококки удаляют, быстро промывая стекла PBS, и клетки фиксируют 60 мин при комнатной температуре 2% -ным раствором четырехокиси осмия в PBS. После этого стекла можно подготовить к сканирующей электронной микроскопии и исследовать.
Подсчет числа связавшихся с клетками стафилококков дает возможность количественно исследовать экспрессию вирусных антигенов на клеточной мембране при условии постановки соответствующих контролей.
3.4 Концентрирование вируса
Предложен простой метод концентрирования РСВ преципитацией полиэтиленгликолем.
1. Готовят 36% -ный раствор ПЭГ 6000 в дистиллированной воде.
2. Раствор охлаждают и добавляют к содержащей вирус жидкости до конечной концентрации ПЭГ 6%.
3. Суспензию инкубируют 2 ч при 4°С.
4. Преципитат собирают центрифугированием при 4°С.
5. Супернатант сливают, осадок дважды промывают буферным раствором и ресуспендируют в небольшом объеме.
3.5 Очистка и радиоактивное мечение РСВ
Клинические изоляты РСВ в основном ассоциированы с клетками, однако при культивировании некоторых лабораторных штаммов в среду выделяется достаточное количество вируса для успешной очистки. Наиболее удобно использовать для этого штаммы Лонг и А2.
3.5.1 Градиентное центрифугирование
В литературе можно встретить не одну методику очистки РСВ градиентным центрифугированием. Представленная ниже была успешно использована для очистки штамма А2.
1. Монослой клеток Нер-2 заражают РСВ. Адсорбцию проводят 2 ч при 37°С, затем добавляют культуральную среду.
2. Через 10 ч после заражения добавляют актиномицин D до концентрации 0,3 мкг/мл. Для радиоактивного мечения РНК через 16-20 ч после заражения заменяют культуральную среду на свежую, содержащую 20 мкКи/мл - уридина. Для введения метки в белки в среду добавляют 5 мкКи/мл - метионина.
3. При проявлении ЦПД и образовании синцитиев собирают культуральную жидкость. Клеточный дебрис удаляют центрифугированием 20 мин при 11000 g и концентрируют вирус центрифугированием 90 мин при 65000 g на холоду.
4. Осадок ресуспендируют в буфере NTE при ультразвуковой обработке.
