Моделирование состава жидких фармформ на основе азотсодержащих органических трииодидов
Известно, что иодсодержащие соединения обладают высокой антимикробной и антивирусной активностью [1]. Синтезированы новые биологически активные соединения - трииодиды азотсодержащих органических катионов: 1,3-диметилбензимидазолия (I), 1,3-диэтилбензимидазолия (II), N-децилпиридиния (III), N-цетилпиридиния (IV), N-метилуротропиния (V), тетраэтиламмония (VI). Сочетание биологической активности иодсодержащих соединений и токсичности свободного иода делает необходимым точное установление формы существования иода в составе органических азотсодержащих соединений. Подбор оптимальных условий синтеза с учетом влияния иодкоординирующего растворителя позволит прогнозировать образование биологически активных форм с заданной способностью освобождать молекулярный иод.
На основании спектрофотометрического исследования равновесия KtI+nI2 = KtI2n+1 в хлороформных растворах сделана оценка предельного количества молекул иода, координируемых иодидами азотсодержащих органических катионов: одна - для иодидов производных бензимидазолия и тетраэтиламмония с образованием структуры KtI3 и две - для иодидов трех остальных катионов с образованием структуры KtI5. Впервые для расчета констант устойчивости полииодиодидов предложена функция nI2 - среднеиодное число [2]. Найденные значения констант устойчивости органических трииодидов (1) и пентаиодидов (2) позволяют рассчитать мольные доли продуктов взаимодействия иода с иодидами I-VI от концентрации свободного иода в хлороформной среде по уравнению:
ф = А / (1 + 1 [I2] + 2 [I2]2),
где А = 1 для KtI; A = 1 [I2] для трииодидов; A = 2 [I2] для пентаиодидов.
Концентрация свободного иода определялась спектрофотометрически для каждого значения аналитической концентрации иода (СI2) по индивидуальной полосе поглощения иода, выделенной из суммарной спектральной кривой методом традиционного нелинейного регрессионного анализа [3]. Кривые распределения для систем II - I (а) и III - I (б) представлены на рис. 1.
Зависимости мольных долей образующихся органических трииодидов и пентаиодидов в хлороформной среде от концентрации иода предоставляют возможность подобрать оптимальные условия синтеза трииодидов I-VI при минимальной примеси иодида и пентаиодида.
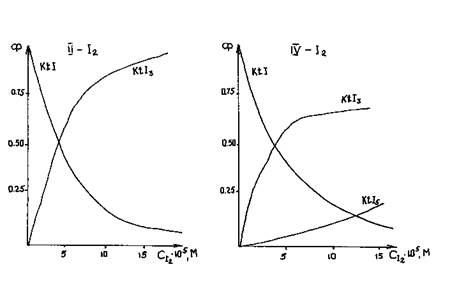
Рис.1. Кривые распределения продуктов взаимодействия иода с органическими азотсодержащими иодидами в хлороформной среде CKtI = 5 ·10-5 моль/л.
|
CII, моль/л |
ФII в ДМСО |
ФII в этаноле |
|
3,6.10-1 1,0.10-2 1,0.10-3 1,0.10-4 |
0,96 0,80 0,50 0,15 |
0,99 0,92 0,76 0,43 |
Мольные доли субстанции II в растворе для различных растворяемых концентраций.
Для приготовления жидких фармформ обычно используют малотоксичные кислородсодержащие органические растворители, такие как этанол или диметилсульфоксид (ДМСО). Однако иод (свободный или в составе комплексного аниона) активно взаимодействует с этими растворителями (S), образуя молекулярные комплексы:
I2 + S = SI2 или KtIn + S = KtIn-2 + SI2,
что влияет на устойчивость фармсубстанции в используемом растворителе.
Спектрофотометрическим методом исследовано взаимодействие иода с кислородсодержащими органическими растворителями и определены константы устойчивости и оптические характеристики их молекулярных комплексов. Результаты сопоставлены с неэмпирическими расчетами в базисе 3-21G(d,p) теплот образования молекулярных комплексов [3]. С учетом полученных величин - констант устойчивости молекулярных комплексов иода с этанолом (Кмк = 0,37) и ДМСО (Кмк = 3,38), количественно оценена реальная устойчивость лекарственных субстанций I-VI различных концентраций в иодкоординирующих растворителях:
b = 1 / (1 + Kмк[S]).
На основании этого рассчитаны мольные доли для различных концентраций лекарственной субстанции II в этаноле и ДМСО (двух наиболее часто применяемых для приготовления жидких фармформ растворителей) по уравнению
Ф = [II]/CII = b[I2]/(1 + b[I2]).
Результаты представлены в таблице.
Очевидно, для того, чтобы содержание биологически активной формы KtI3 в жидкой матрице было максимальным, необходимо использовать концентрации не ниже 0,01 моль/л.
Списоклитературы
Stang P.J., Zhdankin V.V. Organic polyvalent iodine compounds // Chem. Rew. 1996. Vol.96. N 3-5. P.1123-1178.
Черновьянц М.С., Подгорная Е.Б., Пыщев А.И., Щербаков И.Н. Исследование влияния природы органического азотсодержащего катиона на возможность образования и устойчивость полииодиодидных соединений // Журнал общей химии. 1998. Т.68 (130). N 5. С.822-825.
Джонсон К. Численные методы в химии. М.: Мир, 1983. 285с.
Подгорная Е.Б., Черновьянц М.С., Щербаков И.Н., Пыщев А.И. Исследование комплексообразования иода с кислородсодержащими органическими растворителями // Журнал общей химии. 1999. Т.69 (В печати).
