Мозг наркомана
А путь ВОП—прилежащее ядро тем временем действует как реостат вознаграждения: он сообщает другим мозговым центрам, в какой степени активность особи способствует достижению вознаграждения. Чем выше эта оценка, тем больше вероятность того, что организм запомнит эту форму активности и повторит её впоследствии.
Хотя основные представления о деятельности мозговой системы вознаграждения сложились в результате экспериментов на животных, исследования, проведённые за последние 10 лет методами нейровизуализации, показали, что аналогичные нервные структуры контролируют поведение, связанное с естественным или наркотическим вознаграждением, и у человека. С помощью магнитно-резонансной и позитронной эмиссионной томографии было установлено, что предложение понюхать кокаин вызывало у наркоманов рост нейронной активности в прилежащем ядре. Точно так же это ядро (а кроме него — миндалина и некоторые области коры) отреагировало и на демонстрацию испытуемым видеоклипа, где кокаин нюхали другие люди. А у заядлых игроков эти области мозга активизировались в ответ на предъявление фотографий игровых автоматов. Таким образом, можно предположить, что нервный путь ВОП—прилежащее ядро играет важную роль в развитии болезненного привыкания и ненаркотической зависимости.
Участие дофамина
Почему на мозговую систему вознаграждения одинаково воздействуют кокаин, который, как известно, увеличивает частоту сердечного ритма, и героин, являющийся по сути дела обезболивающим седативным средством? Причина ясна: приём всех наркотиков вызывает усиленный приток дофамина (а иногда и сигналов, имитирующих его действие) к прилежащему ядру.
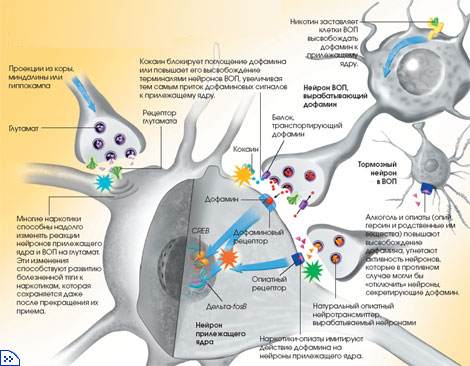
Когда нейроны ВОП возбуждаются, они посылают по своим аксонам электрические сигналы к прилежащему ядру. Те, в свою очередь, стимулируют высвобождение дофамина из кончиков аксона в крошечное пространство — синаптическую щель, разделяющую аксонную терминаль и нейрон прилежащего ядра. Здесь дофамин связывается соответствующими рецепторами в мембране нейронов прилежащего ядра, и сигнал поступает внутрь клетки. Когда сигналы нужно „выключить“, нейрон ВОП удаляет избыток дофамина из синаптической щели и сохраняет его в аксоне до тех пор, пока вновь не возникнет необходимость послать сигнал нейронам прилежащего ядра.
Кокаин и прочие наркотики-стимуляторы на какое-то время выводят из строя белок, транспортирующий дофамин из синаптической щели в аксонную терминаль нейрона ВОП. Таким образом, в синаптической щели остаётся избыток дофамина, продолжающий действовать на нейроны прилежащего ядра. Героин и другие опиаты ведут себя иначе. Они связываются с нейронами ВОП, ответственными за „отключение“ других нейронов этой же области — тех, что высвобождают дофамин. Последние начинают бесконтрольно изливать избыточное количество дофамина на нейроны прилежащего ядра. Кроме того, опиаты способны порождать мощный сигнал вознаграждения, непосредственно воздействуя на прилежащее ядро.
Однако действие наркотиков не ограничивается стимуляцией выброса дофамина, вызывающего эйфорию. Чтобы приспособиться к воздействию наркотиков, система вознаграждения постепенно изменяется — так возникает наркотическое привыкание.
Привыкание
На ранних стадиях потребления наркотиков у животных и людей развивается устойчивость к их действию (т. е. организм привыкает к дозе, и она не оказывает того действия, как раньше) и зависимость от них. Чтобы поднять настроение, наркоману каждый раз приходится незначительно увеличивать дозу препарата, что неизбежно порождает абстинентный синдром. Таким образом систематическое потребление наркотиков подавляет отдельные звенья мозговой системы вознаграждения.
В этом процессе участвует белок, связывающийся с cAMP-зависимым элементом (cAMP response element-binding protein, CREB). CREB представляет собой фактор транскрипции — белок, регулирующий экспрессию (активность) генов, а значит, и поведение нервных клеток в целом. Когда вводится наркотик, концентрация дофамина в прилежащем ядре повышается, что заставляет нервные клетки, чувствительные к нему, усиливать выработку циклического аденозинмонофосфата (сАМР) — вещества-посредника, активирующего CREB. Активированный CREB связывается со специфическими участками генов, инициируя синтез кодируемых ими белков. Но в подавлении мозговой системы вознаграждения участвует не только CREB. Через несколько дней после прекращения приема наркотика этот фактор транскрипции инактивируется. Поэтому действием CREB нельзя объяснить, например, изменения, заставляющие наркоманов возобновлять приём препаратов после многих лет и даже десятилетий воздержания. Рецидивы во многом обусловлены сенситизацией — усилением действия наркотиков.
Как ни парадоксально, но в отношении одного и того же препарата у человека и животного может развиваться как снижение восприимчивости организма к наркотику, так и сенситизация. Вскоре после приёма наркотического вещества возрастает активность CREB и повышается устойчивость к его действию: в течение нескольких дней для стимуляции системы вознаграждения организму требуется всё большее количество наркотического препарата. Но если его приём прекращается, активность CREB падает, в результате чего развивается сенситизация, порождающая потребность в наркотике. Неослабевающая тяга сохраняется даже после длительных периодов воздержания. Чтобы понять природу сенситизации, необходимо в первую очередь выяснить, какие молекулярные изменения могут сохраняться в течение периода, превышающего несколько дней. В голову тут же приходит мысль о другом факторе транскрипции — дельта-fosB.
Наркотический срыв
Дельта-fosB связан с развитием наркотического привыкания совсем иначе, нежели CREB. В опытах на мышах и крысах было установлено, что постоянное систематическое потребление наркотиков приводит к постепенному и стабильному увеличению концентрации этого белка в прилежащем ядре и других структурах головного мозга. Кроме того, поскольку дельта-fosB отличается необычайной устойчивостью, он остаётся активным в нейронах этих структур спустя недели и месяцы после приёма препаратов. Такая активность вполне могла бы позволить белку поддерживать изменения в экспрессии генов ещё долгое время после прекращения приёма наркотиков.
|
Различные наркотики воздействуют на разные структуры головного мозга, но так или иначе увеличивают приток дофаминовых сигналов к прилежащему ядру. Знание структур-мишеней порождает новые идеи о терапевтических подходах. |
Как показывают исследования мутантных мышей с чрезмерной выработкой дельта-fosB в прилежащем ядре, эти животные сверхчувствительны к наркотикам. Они с необычайной лёгкостью возобновляли приём препарата после его длительной отмены. Интересно отметить, что дельта-fosB вырабатывался у экспериментальных мышей и в ответ на повторные вознаграждения ненаркотической природы (например, быстрый бег в беличьем колесе или потребление сахара). Таким образом, вполне вероятно, что дельта-fosB принимает участие в развитии привыкания к гораздо более широкому спектру удовольствий, чем наркотические препараты.