Молекулярные механизмы многообразия антител
СОДЕРЖАНИЕ:
Введение
1. Строение антител
1.1 Функциональные свойства антител
1.2 Строение антител и их многообразие
1.3 Тонкая структура антител
2. Молекулярные механизмы многообразия антител
Список литературы
ВВЕДЕНИЕ
По имеющимся оценкам, у мыши может вырабатываться от 106 до 1012 различных молекул антител, совокупность которых называют репертуаром. Этот репертуар, видимо, достаточно велик для того, чтобы почти для каждой антигенной детерминанты нашелся подходящий антиген-связывающий участок. Поскольку антитела представляют собой белки, а белки копируются генами, способность животного производить миллионы разных антител представляет собой чрезвычайно сложную генетическую проблему: как синтезировать миллиарды разных белков, не привлекая к этому чрезмерно большого числа генов. В решении этой проблемы участвует ряд уникальных вне генетических механизмов.
1. СТРОЕНИЕ АНТИТЕЛ
Иммунная система выработалась в процессе эволюции позвоночных для защиты от инфекций. Она состоит из миллиардов лимфоцитов и включает миллионы различных клонов. Лимфоциты каждого клона несут на своей поверхности рецептор, который позволяет им связывать ту или иную «антигенную детерминанту» - определенную группировку в молекуле антигена. Существуют два класса лимфоцитов: В-клетки, вырабатывающие антитела, и Т-клетки, которые осуществляют иммунные реакции клеточного типа.
Уже на ранних стадиях своего развития В- и Т-клетки с рецепторами для антигенных детерминант молекул собственного организма элиминируются или супрессируются; в результате иммунная система в норме способна отвечать только на чужеродные антигены. Связывание чужеродного антигена с лимфоцитом вызывает иммунный ответ, направленный против этого антигена. При этом некоторые из лимфоцитов пролиферируют и дифференцируются в клетки памяти, так что при вторичном воздействии того же антигена иммунный ответ развивается быстрее и оказывается гораздо более сильным.
1.1 Функциональные свойства антител
Единственная известная функция В-лимфоцитов – выработка антител. Уникальная особенность антител, отличающая их от всех других известных белков, состоит в том, что они могут существовать в миллионах разновидностей – каждая со своим уникальным участком для связывания антигена. В совокупности называемые иммуноглобулинами(сокращенно Ig) антитела образуют один из основных классов белков крови, составляя по весу примерно 20% суммарного белка плазмы.
Как и предсказывала гипотеза клональной селекции, все молекулы антител, производимые какой-то одной В-клеткой, имеют одинаковый антиген-связывающий участок. Первые антитела, синтезированные вновь образовавшейся В-клеткой, не секретируются; вместо этого они встраиваются в плазматическую мембрану, где служат рецепторами для антигена. Каждая В-клетка имеет на своей плазматической мембране приблизительно 105 таких молекул. Когда антиген присоединяется к молекулам антител на поверхности покоящейся В-клетки, это обычно инициирует сложную и малоизученную цепь событий, приводящую к клеточной пролиферации и дифференцировке с образованием клеток, секретирующих антитела. Такие клетки, вырабатывают большие количества растворимых (не связанных с мембраной) антител с таким же антиген-связывающим участком, что и у антител на поверхности клеток, и выделяют эти антитела в кровь. Активированные В-клетки могут начать секретировать антитела, будучи еще малыми лимфоцитами; конечная стадия этого пути дифференцировки - большая плазматическая клетка, которая выделяет антитела со скоростью около 2000 молекул в секунду. По-видимому, плазматические клетки используют для производства антител столь значительную часть мощности своего белоксинтезирующего аппарата, что не способны к дальнейшему росту и делению и погибают после нескольких дней секреции антител.
Простейшие молекулы антител имеют форму буквы Y с двумя идентичными антиген-связывающими участками – по одному на конце каждой из двух «ветвей» (рис. 1). Поскольку таких участков два, эти антитела называют валентными. Такие антитела могут сшивать молекулы антигена в обширную сеть, если каждая молекула антигена имеет три или большее число антигенных детерминант. Достигнув определенных размеров, такая сеть выпадает из раствора. Как мы увидим позже, тенденция больших иммунных комплексов к осаждению (преципитации) удобна для выявления антител и антигенов. Эффективность реакций связывания и сшивания антигена антителами значительно возрастает благодаря гибкому шарнирному участку в месте соединения обеих «ветвей» с «хвостом»: этот участок позволяет изменять расстояние между двумя антиген-связывающими участками (рис. 2). Защитное действие антител объясняется не просто их способностью связывать антиген. Они выполняют и целый ряд других функций, в которых участвует «хвост». Эта область молекулы определяет, что произойдет с антигеном, если он оказался связанным. Антитела с одинаковыми антиген-связывающими участками могут иметь весьма разные «хвостовые» области, а потому и разные функциональные свойства.
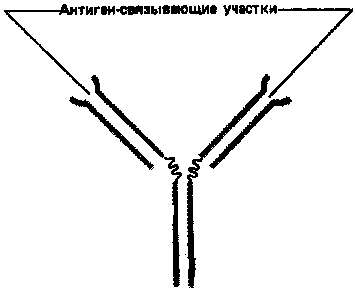
Рисунок 1. Сильно упрощенная схема молекулы антитела с двумя идентичными антиген-связывающими участками.
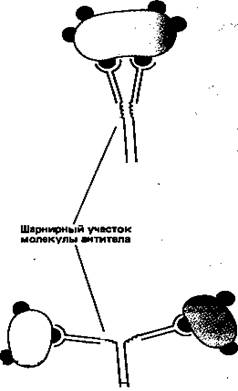
Рисунок 2. Шарнирный участок молекулы антитела повышает эффективность связывания молекул антигена и сшивания их друг с другом.
1.2 Строение антител и их многообразие
Основную структурную единицу молекулы антитела образуют четыре полипептидные цепи – две идентичные легкие (L-цепи, каждая примерно из 220 аминокислот) и две идентичные тяжелые (Н-цепи, каждая примерно из 440 аминокислот). Все четыре цепи соединены между собой с помощью нековалентных взаимодействий и ковалентных связей (дисульфидных мостиков). Молекула состоит из двух одинаковых половинок, в которых L- и Н-цепи вносят почти равный вклад в построение двух идентичных антиген-связывающих участков (рис. 3).
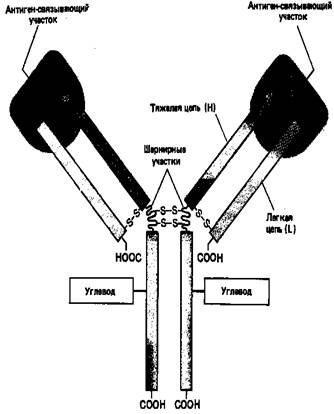
Рисунок 3. Схематическое изображение типичной молекулы антителу состоящей из двух идентичных тяжелых (Н) и двух идентичных лёгких (L) цепей. Антиген-связывающие участки формируются за счет комплекса N-концевых областей L- и Н-цепей, а область «хвоста» образуют только Н-цепи. Каждая цепь содержит одну или несколько олигосахаридных цепочек, функция которых не известна.
Протеолитические ферменты папаин и пепсин расщепляют молекулы антител на различные характерные фрагменты: папаин дает два отдельных идентичных Fab-фрагмента, каждый из которых обладает одним антиген- связывающим участком, и один Fc-фрагмент (Fab - сокращение слов fragment antigen binding; Fc означает «кристаллизующийся фрагмент» (от crystallizable).; пепсин дает один Р(аb')2-фрагмент, состоящий из двух ковалентно связанных Р(аb')-фрагмент (каждый из которых немного больше, чем Fab-фрагмент), и много более лёгких фрагментов (рис. 4). Поскольку Р(аb')2-фрагменты бивалентны в отличие от моновалентных Fab-фрагментов сохраняют способность связывать антигены и образовывать преципитаты. Ни один из этих фрагмент обладает другими биологическими свойствами нативных молекул антигенов поскольку они не содержат «хвостовой» (Fc) области, определяющей их свойства.
