Определение способности почвенных бактерий к разложению синтетических моющих средств
Химическая структура полиакриламида
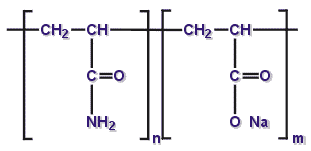
Способность ПАА к химическим превращениям с образованием различных ионных производных, разветвленных и сшитых продуктов расширяет области применения полимеров. Рассмотрим наиболее важные химические свойства ПАА (Савицкая, 1969).
ПАА легко гидролизуется в присутствии кислот и щелочей. Взаимодействует с формальдегидом в щелочной среде (рН 8–10) при 20 оС с образованием полиметилолакриламида, который применяется для аппретирования тканей (пропитка или обработка поверхности с целью придания несминаемости и жесткости), обезвоживания осадков сточных вод и обогащения железных руд.
При обработке ПАА формальдегидом и вторичным амином в щелочной среде образуется аминометилированный полимер, который по флокулирующей способности превосходит исходный полимер.
Реакция сульфометилирования необходима для получения анионных производных ПАА при взаимодействии его с формальдегидом и бисульфитом натрия в щелочной среде (рН 13).
В составе макромолекул наряду с сульфометилированными группами могут содержаться карбоксилатные группы (вследствие щелочного гидролиза амидных групп), а также непрореагировавшие амидные группы. В этом случае получаются эффективные структурообразователи грунтов, антистатические агенты для текстильных материалов и флокулянты для различных типов суспензий (Савицкая, 1969).
Реакции сшивки ПАА применяют для получения водопоглощающих изделий, пленок, защитных покрытий и капсул для лекарств, семян, удобрений. Образование трехмерных структур возможно также при действии на ПАА кислотами (Петрянова-Соколова, 1987).
1.4 Влияние поверхностно-активных веществ на микроорганизмы
Многие синтетические поверхностно-активные вещества обладают антимикробными свойствами. (Ставская, 1981).
Кроме природной устойчивости некоторых микроорганизмов к биоцидным препаратам, микроорганизмы быстро адаптируются к неблагоприятным факторам, в том числе и к воздействию антимикробных средств. Этот феномен объясняется, в первую очередь, выживанием в условиях контакта с биоцидом наиболее устойчивых (резистентных) штаммов бактериальной популяции. В итоге, вследствие мутации, выживают клетки, имеющие измененный ген. Описаны случаи размножения потенциально патогенных микроорганизмов в растворах, предназначенных для дезинфекции, адаптации к терапевтическим дозам антибиотиков и полирезистентности к десяткам антимикробных средств.
Антимикробное действие ПАВ зависит, прежде всего, от типа соединения. Наиболее высокое бактерицидное действие проявляют катионные вещества, неионогенные – слабое, анионактивные занимают промежуточное положение.
Анионные ПАВ влияют главным образом на грамположительные бактерии (Ставская, 1981, цит. Kaminski, 1963). Антимикробный эффект АПАВ зависит от их химического строения. Чем больше атомов углерода, тем сильнее действие соединения. Активность анионных соединений усиливается при снижении рН среды (Ставская, 1981, цит. Flett, 1945).
Неионогенные вещества характеризуются более слабым антимикробным действием; некоторые из них совсем не обладают активностью. Характер влияния на микроорганизмы зависит от химического строения НПАВ. Твины не только не угнетают микроорганизмы, но даже стимулируют их рост (Ставская, 1981, цит. Stinson, 1971). В присутствии неионогенных ПАВ в значительных концентрациях не наблюдается спороношения у мицелиальных грибов, хотя и происходит их рост (Ставская, 1981, цит. Furuta 1945).
Катионные ПАВ активны по отношению к грамположительным и грамотрицательным микроорганизмам. По отношению к грибам катионные вещества наиболее активны (Ставская, 1981, цит. Furuta, 1945). В присутствии полисахаридов (агар-агара, крахмала, целлюлозы) и белковых веществ (казеина, сыворотки крови, пептона, желатины, альбумина) снижается антимикробная активность ряда катионных и амфотерных ПАВ. Причем бактериостатическое действие на грамотрицательные бактерии снижается в большей степени, чем на грамположительные, в то время как бактерицидное действие уменьшается одинаково (Ставская, 1981, цит. Koppensteiner, 1974).
Для катионных ПАВ мишенями являются карбоксильные группы аминокислот и кислых полисахаридов бактерий, а для анионных ПАВ – кетонные группы белков, аминогруппы соответствующих углеводов и липидов, а также фосфатные группы тейхоевых кислот.
В естественных условиях микробные клетки обладают общим отрицательным зарядом, поэтому наиболее широкое практическое применение нашли катионные ПАВ, которые губительно действуют на грамположительные и грамотрицательные бактерии, дрожжевые и нитчатые грибы. Но в клетке также имеются молекулы, несущие положительные заряды, поэтому и анионные ПАВ губительно действуют на микроорганизмы, но при более высоких концентрациях.
Сильное дестабилизирующее действие на мембраны клеток оказывают низкомолекулярные катионные ПАВ (цитилпиридиний хлорид, хлоргексидин, алкилди-метил бензил аммоний хлорид) (Поликарпов, 2005).
Много исследований посвящено изучению механизма антимикробного действия ПАВ. Известно, что химические вещества могут влиять на микроорганизмы специфически и неспецифически. Специфически – при очень низких концентрациях антимикробного соединения, которое может реагировать с определенными компонентами клетки, нарушая их нормальное функционирование. Неспецифическое действие на клетку обычно проявляется при достаточно высоких концентрациях веществ. Оно может быть связано с неблагоприятным для микроорганизма изменением поверхностного натяжения, рН, с установлением высокого осмотического давления и т.д. Что касается ПАВ, то до сих пор не существует единого мнения, как – специфически или неспецифически – влияют они на микроорганизмы.
Большинство исследователей предполагают, что ПАВ действуют на микроорганизмы специфически. Эту мысль подтверждает тот факт, что неионогенные ПАВ, которые понижают поверхностное натяжение, почти не обладают антимикробной активностью (Ставская, 1981).
Все работы, посвященные изучению механизма антимикробного действия ПАВ, проводились в таких основных направлениях: изучение адсорбции ПАВ и образования комплексов на поверхности микробной клетки, изучение электрохимических свойств поверхности клетки в присутствии ПАВ, наблюдение изменения проницаемости микробных клеток под влиянием этих соединений и определение их действия на физиологические процессы и ферментативную активность микроорганизмов (Ставская, 1981).
Адсорбцию ПАВ на поверхности микробной клетки считают первым этапом взаимодействия микроорганизмов с химическим соединением.
Методом микроэлектрофореза показано, что ионные ПАВ, адсорбируясь на клеточной поверхности бактерий, изменяют ее заряд. При этом катионактивные вещества уменьшают отрицательный заряд и даже могут изменять его на положительный, тогда как анионные соединения, как правило увеличивают отрицательный заряд (Ставская, 1981, цит. Dyar 1946).
В результате взаимодействия ПАВ с компонентами поверхности микробной клетки изменяются ее свойства. Некоторые ПАВ вызывают удлинение, утолщение и искривление бактериальных клеток (Ставская, 1981, цит. Schweisfurth, 1959).
