Организм и внешняя среда
Реакция эта обратима в зависимости от концентраций КФ и АТФ: когда концентрация КФ высока, а АТФ низка, она идет вправо, а при обратных соотношениях — влево. Таким образом, в ходе этой реакции избыток АТФ создает предпосылки для собственной ее экстренной регенерации. Естественно, что вследствие большого и непрерывного расходования АТФ она чрезвычайно быстро обменивается: полупериод жизни ее менее 1 мин, и за 1 сут каждая молекула ее обновляется (расщепляется и вновь регенерируется) 2400 раз!
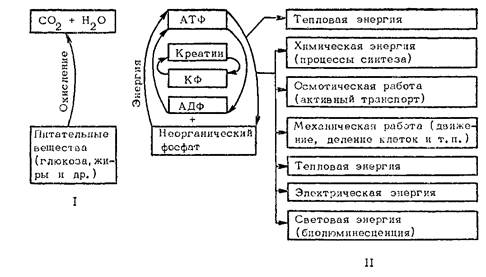
Расходование и генерирование АТФ: І — освобождение энергии, ІІ — преобразование энергии и совершаемая работа

Реакция перефосфорилирования (фосфотрансферазная)
Итак, жизнь — постоянное обновление белковых структур организма. Как же происходит этот процесс?
3. Строение белков и их роль в организме
Полное или частичное расщепление белков осуществляется особыми ферментами — внутриклеточными протеиназами и пептидазами — путем гидролиза, т. е. расщепления с присоединением воды по месту разрыва связи: AB + HOH -> АН - ВОН. А вот синтез белков намного сложнее.
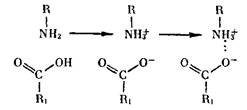
Основными «кирпичиками» белков служат аминокислоты — органические соединения, содержащие щелочную аминогруппу (— NH2) и кислотную — карбоксил (—СООН), т.е. являющиеся одновременно и основаниями, и кислотами:
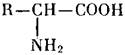
В образовании белков участвует до 20 различных аминокислот, соединяющихся в разной последовательности в длинные цепи, называемые полипептидными. Аминокислоты в них связаны друг с другом группами —NH2 и —COOH так, что к аминогруппе одной аминокислоты присоединяется карбоксил другой и т. д. Такую связь называют пептидной:
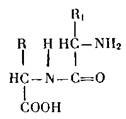
Рассмотрим строение белков подробнее. Эти сведения понадобятся нам в дальнейшем, так как основные приспособительные изменения организма на молекулярном уровне прежде всего и главным образом касаются структуры и свойств клеточных белков. Белки — макромолекулы, в состав которых входит от 100 до нескольких тысяч аминокислотных остатков, что обусловливает их большую ММ, измеряемую десятками и сотнями тысяч атомных единиц массы, диаметром от 5 до 100 нм. Более короткие цепи (от 2 до 10) называют пептидами, а от 10 до 100 аминокислотных остатков — полипептидами. Пептидная цепь — лишь первичная структура белка, способная образовывать высшие структуры: свертывание цепи в клубок (глобулярные белки) или принятие ею нитчатой формы (фибриллярные белки). Связи между атомами, составляющими белковую молекулу, могут быть различными и обладать неодинаковой прочностью. Наиболее npo4Hbf ковалентные связи, т. е. такие, в которых пара электронов находится во владении двух смежных атомов. В белках такими связями соединены остатки аминокислот и атомы, их составляющие. Иначе говоря, первичная структура белка достаточно прочна, так как пептидная цепь построена с помощью ковалентных связей. Но есть связи и другого типа, например водородные, возникающие между двумя атомами с помощью водорода (чаще всего между атомами кислорода и азота). Дело в том, что у кислорода в местах соединения аминокислот друг с другом (т. е. в пептидной связи) имеется небольшой отрицательный заряд, а у азота — небольшой положительный, так как у ядер атома кислорода больше сродство с электронами, чем у ядер азота. Вследствие этого ковалентная пара электронов, связывающая водород с азотом, смещается — и атом водорода оказывается между двумя заряженными центрами:
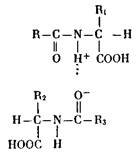
С помощью этих связей образуется вторичная структура белковой молекулы, например спирализация ее, появляются складчатые и нитчатые структуры. При образовании третичной структуры, т. е. пространственной упаковки спирализованных и неспирализованных участков белковой модекулы (например, в шарообразных, глобулярных белках), большое значение имеет возникновение мостиков за счет двух атомов восстановленной серы (R—S —S-Ri, где R и Ri — два участка полипептидной цепи). Кроме того, здесь принимают участие и электростатические (ионные) связи, появляющиеся между двумя ионизированными атомами (опять же, как правило, между азотом и кислородом):
Наконец, четвертичная (наиболее сложная) структура — связь между несколькими одинаковыми или различными белками (называемыми протомерами), объединяющая их в одно целое (олигомер). Такая структура поддерживается ионными или водородными связями. Существуют и другие связи, менее прочные, чем кова-лентные, например взаимодействие свободных групп ОН и СООН, неполярных углеводородных радикалов и др.
Разрыв нековалентных связей приводит к нарушению высших белковых структур, называемому денатурацией белков. При этом белки утрачивают ряд своих функциональных свойств, становятся более доступными действию расщепляющих их ферментов. Денатурация в зависимости от степени ее и условий может быть и обратимой, и необратимой.
4. Нуклеиновые кислоты и синтез белков
Чем же обусловлена строго определенная последовательность аминокислот в белках? Как показали многочисленные исследования, информация об этом закодирована в генном аппарате клеток (геноме), т. е. в ДНК хроматина клеточного ядра. Для каждого синтезируемого в организме белка имеется своя ДНК (или участок цепи ДНК), и синтезированы могут быть только те белки, структура которых закодирована в геноме. ДНК сложные макромолекулы (с MM от 10000 до миллионов атомных единиц), представляющие собой цепи соединенных друг с другом нуклеотидов (от 2000 до IO8 ед.) и образующие двойную спираль.
Каждый нуклеотид состоит из азотистого (пуринового или пиримидинового) основания, пятиуглеродного сахара дезоксирибозы и остатка фосфорной кислоты. Из азотистых оснований в состав ДНК входят аденин, гуанин, цитозин и тимин,2 причем двойная цепь ДНК построена так, что против аденина одной цепи находится тимин другой, а против гуанина располагается цитозин. Между этими парами (так называемыми комплементарными) и образуются связи между двумя цепями ДНК. Каждой входящей в состав того или иного белка аминокислоте соответствует тройка (триплет, или кодон) последовательно соединенных оснований; порядок же аминокислот в белке определяется соответствующим расположением триплетов.
Синтез белка начинается с образования иРНК. РНК отличаются от ДНК тем, что в них вместо тимина присутствует азотистое основание — урацил, вместо дезоксирибозы — рибоза, а также тем, что они одноцепочечные. Синтезируется иРНК в клеточном ядое по образцу соответственной ДНК, как бы считывая часть содержащейся в ней информации, копируя последовательность оснований в ДНК, определяющую структуру синтезируемого белка. Это процесс транскрипции, который можно сравнить с раскроем ткани по выкройке. Затем иРНК покидает ядро и передает полученную информацию в место синтеза — рибосомы, построенные из особой рРНК, т. е. происходит процесс трансляции. При помощи иРНК рибосомы объединяются в комплексы — полирибосомы. Одновременно активируются необходимые аминокислоты и при затрате энергии АТФ соединяются с третьим видом РНК — тРНК, т.е. совершается процесс рекогниции, или узнавания. Активированные аминокислоты транспортируются к рибосомам. Предполагается, что рибосомы движутся вдоль молекулы иРНК и как бы считывают принесенную ею информацию, по мере продвижения синтезируя полипептидную цепь. При этом иРНК расщепляется — и остатки ее используются для синтеза новых иРНК.
